
 CO2+2H2O
CO2+2H2O  2H2O
2H2O  寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
(20分)(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应的电极反应式为 。
(3)电解原理在化学工业中有着广泛的应用。
现将你设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:
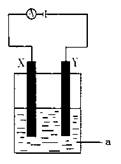
① 若X和Y均为惰性电极,a为CuSO4溶液
则阳极的电极反应式为 ,电解时的化学反应方程式为 ,通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为
③若用此装置电解精炼铜, 做阳极,电解液CuSO4的浓度 (填“增大”、“减小”或“不变”)。
④若用此装置在铁制品上镀铜,铁制品做 ,电镀液的浓度 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省鄄城县第一中学高二上学期期中考试化学试卷 题型:填空题
(20分)(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2 O(1) △H<0
O(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应的电极反应式为 。
(3)电解原理在化学工业中有着广泛的应用。
现将你设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和Y是两块电极板,则: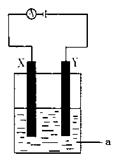
① 若X和Y均为惰性 电极,a为CuSO4溶液
电极,a为CuSO4溶液
则阳极的电极反应式为 ,电解时的化学反应方程式为 ,通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电 极反应式为
极反应式为
③若用此装置电解精炼铜, 做阳极,电解液CuSO4的浓度 (填“增大”、“减小”或“不变”)。
④若用此装置在铁制品上镀铜,铁制品做 ,电镀液的浓度 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2013届山东省高二上学期期中考试化学试卷 题型:填空题
(20分)(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应的电极反应式为 。
(3)电解原理在化学工业中有着广泛的应用。
现将你设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:
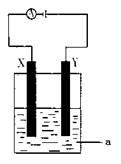
① 若X和Y均为惰性电极,a为CuSO4溶液
则阳极的电极反应式为 ,电解时的化学反应方程式为 ,通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为
③若用此装置电解精炼铜, 做阳极,电解液CuSO4的浓度 (填“增大”、“减小”或“不变”)。
④若用此装置在铁制品上镀铜,铁制品做 ,电镀液的浓度 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2013届山东省高二上学期模块考试化学试卷 题型:填空题
(20分)(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应的电极反应式为 。
(3)电解原理在化学工业中有着广泛的应用。
现将你设计的原电池通过导线与下图中
电解池相连,其中,a为电解液,X和Y是两块电极板,则:
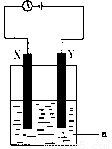
① 若X和Y均为惰性电极,a为CuSO4溶液
则阳极的电极反应式为 ,电解时的化学反应方程式为 ,通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为
③若用此装置电解精炼铜, 做阳极,电解液CuSO4的浓度 (填“增大”、“减小”或“不变”)。
④若用此装置在铁制品上镀铜,铁制品做 ,电镀液的浓度 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com