
在100 mL H2SO4和CuSO4的混合液中,用石墨作电极电解,两极上均收集到2.24 L气体(标准状况下),则原混合液中,Cu2+的物质的量浓度为( )
A.1 mol·L-1 B.2 mol·L-1 C.3 mol·L-1 D.4 mol·L-1
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
在恒容密闭容器中发生反应2NO2  2NO+O2,下列所述可以说明反应达到平衡状态的是
2NO+O2,下列所述可以说明反应达到平衡状态的是
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时生成2n molNO
③混合气体的颜色不再改变
④混合气体的密度不再改变
A.①③ B.②④ C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
A~H均为有机化合物,它们之间的转化关系如图所示
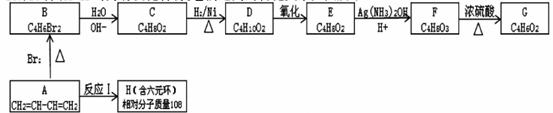
已知:①反应 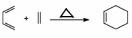
②E既能发生银镜反应,又能与金属钠反应放出氢气。
③核磁共振氢谱表明G分子中有三种氢,且其峰面积之比为1:1:1
(1)A的名称(系统命名法)____________________。
(2)B生成C的反应类型为____________________。
(3)D中含氧官能团的名称为____________________。
(4)由E生成F的第一步反应化学方程式为____________________。与F具有相同官能团的F的同分异构体还有__________种。(填数字)
(5)由A生成H的化学方程式为____________________。
(6)G的结构简式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应2NO2(g) N2O4(g)达到平衡后,在温度不变时欲使c(NO2)/c(N2O4)比值增大,可以采取( )
N2O4(g)达到平衡后,在温度不变时欲使c(NO2)/c(N2O4)比值增大,可以采取( )
A. 体积不变,增加NO2的量 B. 体积不变,增加N2O4的量
C. 使体积扩大到原来的2倍 D. 使体积不变充入N2
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应N2(g)+3H2(g) 2NH3(g),△H=-Q KJ/mol(Q>0)。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molN2和3molH2,在一定条件下达到平衡时放出热量为Q1KJ;在相同条件下,向乙容器中加入2molNH3达到平衡后吸收热量为Q2KJ,已知Q1=4Q2。下列叙述不正确的是( )
2NH3(g),△H=-Q KJ/mol(Q>0)。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molN2和3molH2,在一定条件下达到平衡时放出热量为Q1KJ;在相同条件下,向乙容器中加入2molNH3达到平衡后吸收热量为Q2KJ,已知Q1=4Q2。下列叙述不正确的是( )
A.达到平衡时,两容器中反应物的转化率不同
B. 达到平衡时,甲中NH3的体积分数与乙相等
C. 达到平衡后,再向乙中加入0.2moLN2、0.6molH2、1.6molNH3,平衡向生成NH3的方向移动
D.乙中的热化学反应方程式为2NH3(g) N2(g)+3H2(g);△H=+Q2KJ/mol
N2(g)+3H2(g);△H=+Q2KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化氢和臭氧都是常见的绿色氧化剂,在工业生产中有着重要的用途。
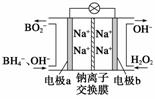 ⑴据报道以硼氢化合物NaBH4(B为+3价)和H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt或C,正极材料采用MnO2,其工作原理如右图所示。该电池放电时正极的电极反应式为_________________________;以MnO2作正极材料,可能是因为_____________________________。
⑴据报道以硼氢化合物NaBH4(B为+3价)和H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt或C,正极材料采用MnO2,其工作原理如右图所示。该电池放电时正极的电极反应式为_________________________;以MnO2作正极材料,可能是因为_____________________________。
⑵火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。已知:
N2H4(l)+O2(g)===N2(g)+2H2O(g),ΔH=-534 kJ·mol-1
 H2O2(l)===H2O(l)+
H2O2(l)===H2O(l)+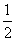 O2(g),ΔH=-98 kJ·mol-1
O2(g),ΔH=-98 kJ·mol-1
H2O(l)===H2O(g),ΔH=+44 kJ·mol-1
试写出N2H4和液态H2O2反应生成气态水的热化学方程式___
__________________________________________。
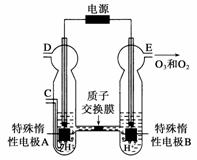
⑶O3可由臭氧发生器(原理如右图所示)电解稀硫酸制得。
①图中阴极为________(填“A”或“B”)。
②若C处通入O2,则A极的电极反应式为____________。
③若C处不通入O2,D、E处分别收集到15.68 L和6.72 L气体(标准状况下),则E处收集的气体中O2和O3的体积之比为__________(忽略O3的分解)。
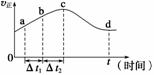 ⑷新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+O3(g)
⑷新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+O3(g) NO2(g)+O2(g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间
NO2(g)+O2(g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间
变化的示意图如右图所示。由图可得出的正确说法是________。
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.该反应为放热反应
d.Δt1=Δt2时,NO的转化量:a~b段小于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
某待测液可能有Fe2+、Fe3+、Ag+、Ba2+、Al3+、Ca2+、NH4+等离子,进行了下述实验(所加酸、碱、NH3水、Br2水都是过量的)。
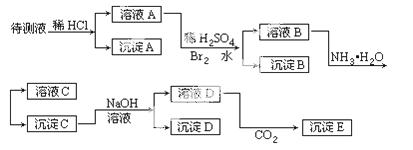
根据实验结果:
(1)判定待测液中有无Ba2+、Ca2+离子,并写出理由。答_________。
(2)写出化学式:沉淀A_________;沉淀D_________;沉淀E_________。
(3)写出下列离子反应方程式:溴水氧化溶液A中的某离子:_________。
沉淀C加入足量NaOH溶液后其中一种沉淀溶解:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为 ( )
A.1:1 B.2:1
C.1:2 D.2:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com