
NA表示阿伏加德罗常数,下列有关叙述正确的是
①1mol苯乙烯中含有的碳碳双键数为4NA
②6.2g氧化钠和7.8g过氧化钠的混合物中含有的离子总数为0.6NA
③3.4gNH3中含N—H键数目为0.2NA
④常温下1L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的物质的量相同
⑤在标准状况下,22.4L 甲烷与18g水所含有的电子数均为10NA
⑥等体积、浓度均为1mol/L的磷酸和盐酸,电离出的氢离子数之比为3:1
⑦56 g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA
⑧1mol 固体NaHSO4含有的阴阳离子总数为2NA
A.①④⑦ B.②⑤⑧ C.②③④⑥ D.①②④⑤⑦
 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
图1和图2是A、B两种物质的核磁共振氢谱。已知A、B两种物质都是烃类,都含有6个氢原子。请根据图1和图2两种物质的核磁共振氢谱谱图选择出可能属于图1和图2的两种物质是( )


A.A是C3H6;B是C6H6 B.A是C2H6;B是C3H6
C.A是C2H6;B是C6H6 D.A是C3H6;B是C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式表达不正确的是
A.用SO2水溶液吸收Br2:SO2 + Br2+2H2O =4H+ + SO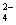 +2Br-
+2Br-
B.用稀硫酸除去铜绿:4H++Cu2(OH)2CO3===2Cu2++CO2↑+3H2O
C.酸性高锰酸钾和过氧化氢制取少量氧气:4MnO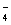 +4H2O2+12H+=4Mn2++7O2↑+10H2O
+4H2O2+12H+=4Mn2++7O2↑+10H2O
D.用惰性电极电解硫酸铜溶液:2Cu2++ 2H2O 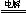 2Cu +O2↑ +4H+
2Cu +O2↑ +4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,若溶液中由水电离产生的c(OH-)=1×10-14mol/L,满足此条件的溶液中一定可以大量共存的离子组是 ( )
A.Al3+、Na+、NO3-、Cl- B.K+、Na+、Cl-、NO3-
C.K+、Na+、Cl-、AlO2- D.K+、NH4+、SO42-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关反应热的叙述正确的是 ( )
A.已知2H2(g)+O2(g) 2H2O(g) △H=-483.6kJ/mol,则氢气的燃烧热为-241.8kJ/mol
B.由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
C.X(g)+Y(g) Z(g)+W(s) △H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
Z(g)+W(s) △H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
D.已知C(s)+O2(g)=CO2(g) △H1 , C(s)+1/2O2(g)=CO(g) △H2,则△H1<△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于电解质溶液的叙述正确的是 A.将pH = 4的盐酸稀释后,溶液中所有离子的浓度均降低
B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)>c(NH4+)>c(H+)=c(OHˉ)
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大
查看答案和解析>>
科目:高中化学 来源: 题型:
某硝酸钠固体中混有少量硫酸铵和碳酸氢钠杂质,现设计一实验方案,既除去杂质,又配成硝酸钠溶液。实验方案:先将固体溶于蒸馏水配成溶液,选择合适的试剂和操作完成表格中各步实验。
| 选择试剂 | ① | Na2CO3溶液 | ④ |
| 实验操作 | ② | ③ | 加热 |
下列试剂或操作不合理的是 ( )。
A.试剂①为Ba(OH)2溶液
B.操作②为结晶
C.操作③为过滤
D.试剂④为稀HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
洗衣粉的主要成分之一是烷基苯磺酸钠,常用的是十二烷基苯磺酸钠,其合成路线如下:

请回答下列问题:
(1) 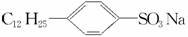 分子中的亲水基是__________,亲油基是__________。
分子中的亲水基是__________,亲油基是__________。
(2)由十二烷基苯制取十二烷基苯磺酸的化学方程式为___________,反应类型为____________________________________________________________。
(3)用油脂可以制肥皂,从硬脂酸甘油酯生成硬脂酸钠和甘油的化学方程式为__________________________________________________,反应类型为________________________________________________________________。
(4)在洗涤剂中添加酶制剂能促进污垢中的蛋白质(如奶渍、肉汤)等水解为可溶性的物质而被除去。使用加酶洗衣粉的水溶液中浸泡10~30 min,水温在40~50 ℃最佳。加酶洗衣粉不宜在高温、潮湿环境中贮存,也不宜久存。为什么? __________________________________________________________。
(5)过去使用的合成洗涤剂中常加入三聚磷酸钠(Na5P3O10)作助剂,它可使硬度大的洗涤水软化,对微细的无机粒子或油脂具有分散、乳化、胶溶作用,防止污渍再次沉积到衣物上;它还能维持水溶液的弱碱性,提高洗涤剂的去污能力和洗涤效果。但是,20世纪90年代以来,世界各国先后提出必须生产和使用无磷洗涤剂。请解释原因______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y元素原子最外层电子数与核外电子总数之比为3∶4,M元素原子的最外层电子数与次外层电子数之比为3∶4,且M原子的质子数是Y原子的2倍;N-、Z+、X+的半径逐渐减小;化合物XN在常温下为气体。据此回答下列问题:
(1)写出Z与N形成的化合物的电子式____________。
(2)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式_____________________________________ _________________________________________(分解反应)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com