
分析 根据溶液的酸碱性与酸碱度的关系以及测定的方法等分析回答.当溶液的pH等于7时,呈中性.当溶液的pH大于7时,呈碱性.当溶液的pH小于7时,呈酸性.石蕊试液遇酸性溶液变红,遇碱性溶液变蓝,遇中性溶液不变色.酚酞试液遇酸性溶液不变色,遇碱性溶液变红,遇中性溶液不变色.
解答 解:溶液的酸碱性用指示剂来检验,溶液的酸碱度用pH试纸来检验.pH数值的范围一般在0~14 之间.pH=7,溶液呈中性;溶液遇酚酞试剂变不变色,溶液呈碱性,pH>7.溶液遇石蕊试剂变红色,溶液呈酸性,pH<7,要中和此溶液,应滴入碱液等,pH变大.
故答案为:指示剂;pH试纸;14;中;不变;>;酸;<;碱;大.
点评 本题主要考查了酸碱性溶液与酸碱指示剂相互作用显色方面的知识,属于基础的知识,应加强记忆,题目较简单.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O | |
| B. | 将少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+ | |
| D. | FeSO4溶液中加入H2O2:2Fe2++H2O2+2H+=2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 二氯化二硫(S2Cl2)是基本有机化工的直接原料,实验室可采用干燥的氯气在110℃-140℃与硫反应,即可得S2Cl2粗品.
二氯化二硫(S2Cl2)是基本有机化工的直接原料,实验室可采用干燥的氯气在110℃-140℃与硫反应,即可得S2Cl2粗品.| 物质 | S | SCl2 | S2Cl2 |
| 熔点/℃ | 112.8 | -78 | -77 |
| 沸点/℃ | 444.6 | 59.6 | 137 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用金属钠或者金属钾 | B. | 利用质谱法 | ||
| C. | 利用红外光谱法 | D. | 利用核磁共振氢谱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;元素Z的离子结构示意图为
;元素Z的离子结构示意图为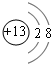 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体熔点由高到低:CI4>CBr4>CCl4>CF4 | |
| B. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 熔点由高到低:Na>Mg>Al | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果某化合物只含共价键,则其一定是共价化合物 | |
| B. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子 | |
| C. | 两种酸溶液充分反应后的体系不可能为中性 | |
| D. | 碳、氮形成的氢化物常温下都是气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
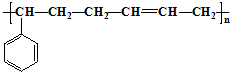 合成这种橡胶的单体应是( )
合成这种橡胶的单体应是( )| A. | ①③ | B. | ②④ | C. | ②⑤ | D. | ①⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com