



 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.MgO、Al2O3、SiO2分别是碱性氧化物、两性氧化物和酸性氧化物 |
| B.三者均可以采用单质在空气中燃烧或加热的方法制得 |
| C.MgO和Al2O3可以作为耐高温材料,SiO2可用于制作光导纤维 |
| D.分别电解熔融状态的MgO、Al2O3、SiO2可以制得Mg、Al、Si |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
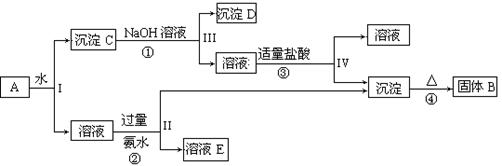
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该物质属于两性氢氧化物 |
| B.该物质是Al(OH)3和Na2CO3的混合物 |
| C.1 mol NaAl(OH)2CO3最多可消耗3 mol H+ |
| D.该药剂不适合于胃溃疡患者服用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
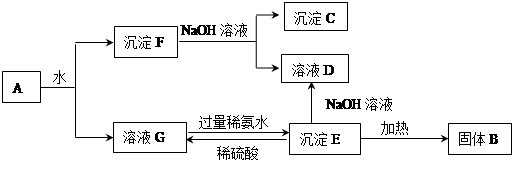
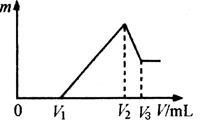
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝与NaOH溶液反应 | B.AlCl3与过量的氨水反应 |
| C.AlCl3与过量的NaOH溶液反应 | D.Al2O3与过量的NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3∶4 | B.9∶32 | C.9∶16 | D.9∶8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
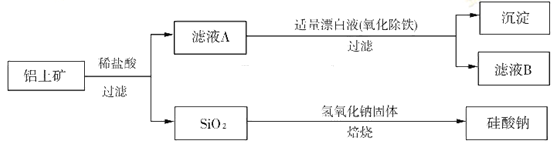
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com