
| A. | 用催化法处理尾气中的CO和NO:CO+NO$\frac{\underline{\;催化剂\;}}{\;}$C+NO2 | |
| B. | 少量SO2通入到Ba(OH)2溶液:SO2+Ba2++2OH-═BaSO3↓+H2O | |
| C. | NH4HCO3溶于过量的NaOH溶液中:HCO3+OH-═CO32-+H2O | |
| D. | 浓盐酸与二氧化锰供热:Mn2O+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O |
分析 A.二氧化氮为有毒气体;
B.二氧化硫少量,反应生成亚硫酸钡沉淀;
C.氢氧化钠过量,碳酸氢根离子、氨根离子都发生反应;
D.氯化氢为强电解质,应拆成离子形式,二氧化锰化学式书写错误.
解答 解:A.用催化法处理尾气中的CO和NO发生反应的化学方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2,故A错误;
B.少量SO2通入到Ba(OH)2溶液反应生成亚硫酸钡沉淀和水,离子方程式:SO2+Ba2++2OH-═BaSO3↓+H2O,故B正确;
C.NH4HCO3溶于过量的NaOH溶液中,离子方程式:NH4++HCO3-+2OH-═CO32-+H2O+NH3•H2O,故C错误;
D.浓盐酸与二氧化锰共热,离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故D错误;
故选:B.
点评 本题考查了化学方程式、离子方程式的书写,明确反应实质、反应物用量对反应的影响是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
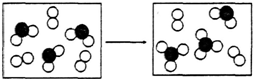 A、B、C、D、E、F是原子序数依次增大的短周期元素,B是短周期中金属性最强的元素,C是地壳中含量最高的金属元素,D单质的晶体是良好的半导体材料,E的最外层电子数与内层电子数之比为3:5,A与E同族.
A、B、C、D、E、F是原子序数依次增大的短周期元素,B是短周期中金属性最强的元素,C是地壳中含量最高的金属元素,D单质的晶体是良好的半导体材料,E的最外层电子数与内层电子数之比为3:5,A与E同族.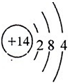
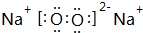 .
. Al(OH)3﹢3H+,生氢氧化铝胶体,能吸附水中悬浮物,使之凝聚达到净水目的
Al(OH)3﹢3H+,生氢氧化铝胶体,能吸附水中悬浮物,使之凝聚达到净水目的查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑨ | ⑩ | ||
| 4 | ② | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
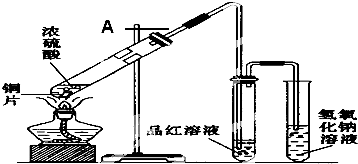
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2 | B. | CO | C. | C12H22O11 | D. | C6H12O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
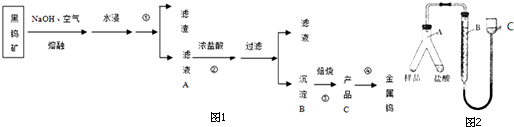
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
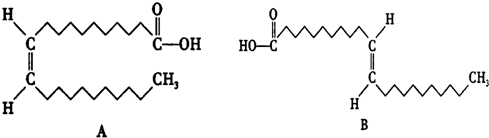
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研发易降解的生物农药符合十八大报告中提到的生态文明建设 | |
| B. | 熟吃西红柿要比生吃维生素C的损失小 | |
| C. | 教育部发出禁令是因为吸烟也会产生多种有害有毒物质 | |
| D. | 大量焚烧田间秸秆会产生雾霾而影响空气质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com