
(12��)ʵ�������ü�ȩ���ⶨ(NH4)2SO4��Ʒ�е��������������䷴Ӧԭ��Ϊ��
4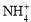 �� 6HCHO �� 3H�� �� 6H2O �� (CH2)6N4H��
�� 6HCHO �� 3H�� �� 6H2O �� (CH2)6N4H��
Ȼ����NaOH����Һ�ζ���Ӧ���ɵ��ᡣij��ȤС���ü�ȩ����������ʵ�飺
[�ζ�ʱ��1 mol (CH2)6N4H����1 mol H�� �൱]
�����ȡ��Ʒ1.500 g
�������Ʒ�ܽ����ȫת�Ƶ�250 mL����ƿ�У����ݣ����ҡ��
�������ȡ25.00 mL��Ʒ��Һ��250 mL��ƿ�У�����10 mL 20%�����Լ�ȩ��Һ��ҡ�ȡ�����5 min����1-2�η�̪��Һ����NaOH����Һ�ζ����յ㡣�����������������ظ�2��
�������ʵ�����ݼ�¼
<��NaOH����Һ��Ũ��Ϊ0.1010 mol/L>
�ζ����� | ����Һ�������mL�� | ����Һ����� | |
�ζ�ǰ�̶ȣ�mL�� | �ζ���̶ȣ�mL�� | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
��������ʵ�鲽����գ�
��1���ζ�����ʱ���۾�Ӧ�۲�
��2���ζ��յ���жϷ�����
��3����ƿ������ˮϴ�Ӻ�ˮδ��������ζ�ʱ��ȥNaOH����Һ����� ���ƫ����ƫС������Ӱ�족��
��4����ʽ�ζ���������ˮϴ�Ӻ�ֱ�Ӽ���NaOH����Һ���еζ���������Ʒ�е���������
�� ���ƫ����ƫС������Ӱ�족��
��5��������Ʒ��Һ���ζ�ʵ��������IJ����������ձ�������������ͷ�ιܡ���Ͳ���ζ����⣬
���� �����������ƣ�
��6������Ʒ�е�����������Ϊ
(1) ��ƿ����Һ����ɫ�仯 (2) ���������һ��NaOH����Һʱ����Һ����ɫ��Ϊdz��ɫ�����ڰ�����ڲ���ɫ (3) ��Ӱ��(4) ƫ�� (5) 250 mL����ƿ����ƿ (6)18.8 5��
��������
���������(1) �ζ�����ʱ���۾�Ӧ�۲���ƿ����Һ����ɫ�仯��(2)�ζ�ǰ��Һʱ���Եģ���̪�����Ի���������ɫ�ģ��ζ�����Һʱ�����Եģ���ʱ��Һʱdz��ɫ�� ���ζ��յ���жϷ����ǣ����������һ��NaOH����Һʱ����Һ����ɫ��Ϊdz��ɫ�����ڰ�����ڲ���ɫ�� (3)�ζ���ԭ��������NaOH����Һ���ⶨ��Һ�е�H+�����ʵ������٣���ƿ��ˮ���ı�H+ �����ʵ������ʶԽ��û��Ӱ�졣(4) ��ʽ�ζ���û����NaOH����Һϴ�ӣ��ᵼ��NaOH����ҺŨ�ȱ�С�������������Ʒ�е��������� ��ƫ�� (5)��Һ���Ƶ�ʱ��Ҫ�õ�250 mL����ƿ���ζ���ʱ�����ҺҪ����ƿʢװ����Ҫ�õ���ƿ��(6)���ݼ�¼�����ݣ�NaOH����Һ����������һ�Σ�20.01 mL���ڶ��Σ�19.99 mL�������Σ�20.00 mL��ȡ���ε�ƽ��ֵΪ��20.00 mL����25.00 mL������Һ��n(H+)= n(0H-)=0.1010 mol/L��20.00 ��10-3L=2.020��10-3mol, �ڸ���4 NH4+�� 6HCHO �� 3H�� �� 6H2O �� (CH2)6N4H����1 mol�� (CH2)6N4H����1 mol H�� �൱�ó���Ӧʱn(NH4+)= n(H+),�����Ƶ�250 mL��Һ��n(NH4+)= n(H+)=2.020��10-3mol��10=2.020��10-2mol������������Ϊ��m=2.020��10-2mol��14g/mol=28.28��10-2g,��������Ϊ��28.28��10-2g��1.5g=18.8 5��
���㣺����к͵ζ��Ļ������������������й����ʵ���Ũ�ȵļ��㡣


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015�ӱ�ʡ��һ12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
ȡa gij��������������ȫȼ�գ������Ϊˮ�Ͷ�����̼�����������������Ĺ������ƹ�����ȫ��Ӧ����Ӧ����������ǡ��Ҳ������a g�����������в������������������
A��H2��CO�Ļ���� B��CH2O2 C��HCHO D��CH4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�㽭ʡ��һ��ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�������
��6�֣�Ϊά������ѪҺ�е�Ѫ�Ǻ������ڸ�������Һʱ��ͨ����������ע��Һ����ͼ��ҽԺ������Һʹ�õ�һƿ��������Ϊ6%�������ǣ�C6H12O6��ע��Һ��ǩ��

������۲��ǩ���������ݺ���㣺
��1������Һ�����ʵ���Ũ��Ϊ mol��L��1��
��2������Һ���ܶ�Ϊ g��mL��1����ȷ��0.1g����
��3������Ӹ�ƿ��ȡ��75g������ע��Һ�������Ϊ15%��ע��Һ����Ҫ���� ______g�����ǹ��壨��ȷ��0.1g����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�㽭ʡ��һ��ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������һ����ı��أ��ڴ������ǵĿ��������ã������йغ�ˮ�ۺ����õ�˵����ȷ����
A.�Ӻ�ˮ����ȡ�嵥��ֻ�������仯����
B.�Ӻ�ˮ�ƺ�����Ҫ��ͨ����ѧ�仯���
C.������ڵ��Ȼ�þ���Ʊ�þ������
D.����Ȼ�����Һ�����Ƶ��ƺ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�㽭ʡ��һ��ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���еĸ���˵���У���ȷ����
A��12C�����ԭ������Ϊ12g��mol��1
B��MgCl2��Ħ��������95 g
C��0.5 mol��Ԫ��Լ��6.02��1023����ԭ��
D��32g O2��O3�Ļ�����У�����2mol��ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�㽭ʡ�߶���ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪����ͬ�¶���Ka(HF)��Ka(HCN)���������ʵ���Ũ�Ⱥ��������ͬ��NaF��NaCN������Һ����֪ǰ����Һ������������ĿΪn1��������Һ������������ĿΪn2�����й�ϵ��ȷ����
A.��ҺpH��NaF��NaCN B.n1 �� n2 C.n1 �� n2 D.c(F��)��c(CN��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�㽭ʡ�߶���ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����йص������Һ��˵����ȷ����
A��������ˮ�еμ�ŨH2SO4��KW����
B��CaCO3������ϡ���ᣬҲ�����ڴ���
C����Na2Sϡ��Һ�У�c(H+)=c(OH-)-2c(H2S)-c(HS-)
D��NaCl��Һ��CH3COONH4��Һ�������ԣ�����Һ��ˮ�ĵ���̶���ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�㽭ʡ�����и߶���ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ������
��12�֣���1������Һ��ʯ��������Ҫ�ɷ�֮һ�Ƕ���(C4H10)����10 kg������ȫȼ�ղ����ɶ�����̼�����Һ̬ˮʱ���ų�������Ϊ5��105 kJ����д������ȼ�յ��Ȼ�ѧ����ʽ�� ����֪1molҺ̬ˮ����ʱ��Ҫ����44 kJ��������ӦC4H10(g)+6��5O2(g) ===4CO2(g)+5H2O(g)�Ħ�H= ��
��2����ͬѧ�ö��������Ϊԭ������һȼ�յ�أ�����ϡ����Ϊ�������Һʱ���为����ӦʽΪ ��
��3����֪��1 mol H��H����1 molN��H����1 molN��N���ֱ���Ҫ��������akJ��bkJ��ckJ����N2��H2��Ӧ����NH3���Ȼ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ϻ�����У������ѧ�����Ͻ�ѧ�������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
�ھ��Ʊ���ʳ��ˮ�м���̼����刺��Ʊ�С�մ�NaHCO3��������ȡ�Ȼ����Ϊ���ϻ��һ���ᴿΪ��ҵ�Ȼ�李��˳�С�մ��ĸҺ��ȡ�Ȼ�������ַ�����
�� ͨ�백����ȴ����ʳ�Σ����� �� ��ͨ������ȴ����ʳ�Σ�����
���������ַ��������д������
A�����������Ȼ�林��ȸ��� B���ٵ���Һ��ֱ��ѭ��ʹ��
C�����������Ȼ�林��Ȳ��� D���ڵ���Һ��ֱ��ѭ��ʹ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com