
分析 取27.2g该酯,完全燃烧后得到70.4gCO2和14.4g水,可知n(C)=n(CO2)=$\frac{70.4g}{44g/mol}$=1.6mol,m(C)=19.2g,
n(H)=$\frac{14.4g×2}{18g/mol}$=1.6mol,m(H)=1.6g,
n(O)=$\frac{27.2g-19.2g-1.6g}{16g/mol}$=0.4mol,
可得n(C):n(H):n(O)=4:4:1,最简式为C4H4O,
根据RCOOCH3+NaOH→RCOONa+CH3OH,结合消耗盐酸的物质的量可计算酯的相对分子质量,根据结构特点可判断有机物的结构简式,以此解答该题.
解答 解:(1)取27.2g该酯,完全燃烧后得到70.4gCO2和14.4g水,可知n(C)=n(CO2)=$\frac{70.4g}{44g/mol}$=1.6mol,m(C)=19.2g,
n(H)=$\frac{14.4g×2}{18g/mol}$=1.6mol,m(H)=1.6g,
n(O)=$\frac{27.2g-19.2g-1.6g}{16g/mol}$=0.4mol,
可得n(C):n(H):n(O)=4:4:1,最简式为C4H4O,式量为68,
酯与NaOH溶液反应消耗的n(NaOH)=0.2mol/L×(0.04L-0.015L)=0.005mol,
RCOOCH3+NaOH→RCOONa+CH3OH,
1 1
n 0.005mol
n(RCOOCH3)=0.005mol,
M(RCOOCH3)=$\frac{0.68g}{0.005mol}$=136g/mol,相对分子质量为136,
答:该酯的相对分子质量为136;
(2)由(1)分析可知最简式为C4H4O,
答:该酯的最简式为C4H4O;
(3)设分子式为(C4H4O)x,
x=$\frac{136}{68}$=2,
则分子式为C8H8O2,
因该有机物是一元羧酸与甲醇生成的酯,该酯不能使溴水褪色,分子中只有一个环状结构,说明应含有苯环,结构简式为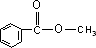 ,为苯甲酸甲酯,
,为苯甲酸甲酯,
答:该有机物的分子式为C8H8O2,结构简式为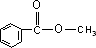 .
.
点评 本题考查有机物的推断,侧重于考查学生的分析能力、计算能力,难度中等,注意从质量守恒的角度和酯水解的特点着手解答该题,答题时注意体会做题思路.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 34g质量分数为4%的H2O2水溶液中含氧原子数目为0.08NA | |
| B. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92kJ/mol,若放出热量4.6kJ,则转移电子数目为0.3NA | |
| C. | 0.1mol•L-1Na2S溶液中所含S2-总数小于0.1NA | |
| D. | 6.4gCu与40mL10mol•L-1浓硝酸作用能生成NO2的分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
| A. | 反应在0~t1 min内的平均速率为v(SO3)=0.088/t1 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.10 mol SO3和0.010 mol O2,到达平衡时,n(SO2)=0.012 mol | |
| C. | 保持其他条件不变,升高温度,平衡时c(SO2)=0.007 0 mol•L-1,则反应的△H>0 | |
| D. | 相同温度下,起始时向容器中充入0.050 mol SO2和0.030 mol O2,达到平衡时SO2转化率大于88% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
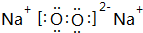 ;属于离子化合物(填“离子”或“共价”);
;属于离子化合物(填“离子”或“共价”); ;属于共价化合物(填“离子”或“共价”);
;属于共价化合物(填“离子”或“共价”);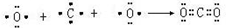 ;
;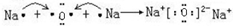 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在容器中充入2mol SO2(g)和2mol O2(g)充分反应,最终放出的热量为196kJ | |
| B. | 如果2molSO3(g)完全分解成SO2(g)和O2(g)时需要吸收196kJ的热量,若加入适当的催化剂后,分解所需要的热量会小于196kJ | |
| C. | 在接触法制硫酸中,通常不采用低温或者很大压强的方式来提高三氧化硫的产率 | |
| D. | 工业生产中,在吸收塔内用水吸收SO3,促进平衡的正向移动,提高了原料利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
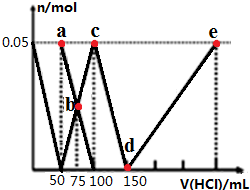
| A. | 原混合溶液中的n(CO32-):n(AlO2-)=1:1 | |
| B. | a点溶液中:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-) | |
| C. | b点溶液中浓度顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-) | |
| D. | d→e的过程中水的电离程度逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
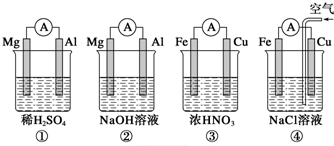
| A. | ①②中Mg作负极,③④中Fe作负极 | |
| B. | ②中Mg作正极,OH-向Al电极移动 | |
| C. | ③中Fe作负极,电极反应式为Fe-2e-=Fe2+ | |
| D. | ④中Cu作正极,电极反应式为2Na++2e-=2Na |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com