
| A. | 1 mol•L-1 | B. | 2 mol•L-1 | C. | 3 mol•L-1 | D. | 4 mol•L-1 |
分析 根据n=$\frac{m}{M}$计算5.85g NaCl和11.1g CaCl2的物质的量,根据氯元素守恒有n(Cl-)=n(NaCl)+2n( CaCl2),据此计算溶液中n(Cl-),再根据c=$\frac{n}{V}$计算溶液中Cl-的物质的量浓度.
解答 解:5.85g NaCl的物质的量为$\frac{5.85g}{58.5g/mol}$=0.1mol,11.1g CaCl2的物质的量为$\frac{11.1g}{111g/mol}$=0.1mol,根据氯元素守恒有n(Cl-)=n(NaCl)+2n( CaCl2)=0.1mol+0.1mol×2=0.3mol,所以溶液中Cl-的物质的量浓度为$\frac{0.3mol}{0.1L}$=3mol/L.
故选:C.
点评 本题考查物质的量浓度的有关计算,难度不大,注意理解物质的量浓度定义,根据化学式判断氯离子与氯化钠、氯化镁的关系是关键.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑦ | B. | ①③⑤⑥⑦ | C. | ①③④⑥⑦ | D. | ②③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4C1反应 | B. | 水解反应 | ||
| C. | 醋酸的电离 | D. | 盐酸与NaOH溶液的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
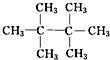
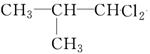 、
、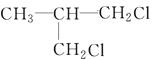 、
、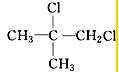 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 澄清的石灰水跟稀硝酸反应:Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 氢氧化钡溶液和硫酸铜溶液反应:Ba2++SO42-=BaSO4↓ | |
| C. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O | |
| D. | 往澄清石灰水中通入少量二氧化碳气体:CO2+OH-=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | |
| 正丁醇 | -89.53 | 117.25 | 0.81 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.28 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com