
| | 实验目的 | 实验步骤及现象 |
| A | 检验亚硫酸钠试样是否变质 | 试样  白色沉淀 白色沉淀 沉淀不溶解 沉淀不溶解 |
| B | 制取氯气并探究氯气是否具有漂白性 | MnO2和稀盐酸 气体 气体 褪色 褪色 |
| C | 证明酸性条件H2O2氧化性比I2强 | 碘化钠溶液 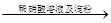 溶液变蓝色 溶液变蓝色 |
| D | 探究浓度对于化学平衡的影响 | FeCl3和KSCN混合溶液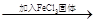 红色变深 红色变深 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:实验题
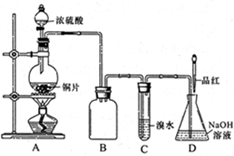
| 实验序号 | 实验操作 | 现象 | 反应的可能情况 |
| ① | 滴加少量淀粉碘化钾溶液,振荡 | | III |
| ② | 滴加少量棕红色的KI3溶液,振荡 | | II |
| ③ | 滴入加少量酸性KMNO4溶液,振荡 | 溶液呈紫色 | |
| ④ | 加入几小块CaCO3固体 | 有气泡产生 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

 NH4NO2+NaCl
NH4NO2+NaCl NH3↑+HNO2
NH3↑+HNO2 N2O3↑+H2O
N2O3↑+H2O 2N2+3H2O
2N2+3H2O| N2和H2的体积比 | 5∶1 | 3∶1 | 1∶1 | 1∶3 | 1∶5 |
| 酚酞变红色所需时间/min | 8~9 | 7~8 | 6~7 | 3~4 | 9~10 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.t1时刻锌镀层已完全反应 |
B.锌镀层的厚度为 |
| C.反应放热也是影响OA段的反应速率的因素之一 |
| D.有原电池反应发生,正极的电极反应式为Zn - 2e → Zn2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| A.科学性 | B.安全性 | C.可行性 | D.简约性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题


| A.磷铵样品与氢氧化钠未充分反应 | B.A和B中残留了一定量的氨气 |
| C.氢氧化钠溶液的浓度太大 | D.鼓气过快 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.上下移动①中铜丝可控制SO2的量 |
| B.②中品红溶液不褪色 |
| C.③中石蕊溶液变蓝色 |
| D.为确认CuSO4生成,向①中加水,观察溶液颜色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com