(2012?门头沟区一模)无水AlCl
3易升华,可用作有机合成的催化剂等.工业上由铝土矿(主要成分是Al
2O
3和Fe
2O
3)和石油焦(主要成分是C)为原料制备无水AlCl
3的工艺(碳氯化法)流程如下:
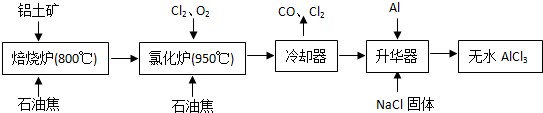
(1)氯化炉中Al
2O
3、Cl
2和C反应的化学方程式为
.
(2)用Na
2SO
3溶液可除去冷却器排出尾气中的Cl
2,此反应的离子方程式为
SO32-+C12+H2O═SO42-+2C1-+2H+
SO32-+C12+H2O═SO42-+2C1-+2H+
.
(3)升华器中主要含有AlCl
3和FeCl
3,需加入一定量Al,其目的是
除去FeCl3
除去FeCl3
.
(4)为测定制得的无水AlCl
3产品(含少量FeCl
3杂质)的纯度,称取16.25g无水AlCl
3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32g.
①此过程涉及反应的离子方程式为
Fe3++3OH-=Fe(OH)3↓
Fe3++3OH-=Fe(OH)3↓
、
Al3++4OH-=AlO2-+2H2O
Al3++4OH-=AlO2-+2H2O
.
②AlCl
3产品的纯度为
96%
96%
.
(5)工业上另一种由铝灰为原料制备无水AlCl
3工艺中,最后一步是由AlCl
3?6H
2O在氯化氢的气流中加热脱去结晶水而制得无水AlCl
3,其原因是
Al3++3H2O?Al(OH)3+3H+,抑制AlCl3水解
Al3++3H2O?Al(OH)3+3H+,抑制AlCl3水解
.




 阅读快车系列答案
阅读快车系列答案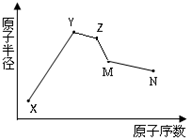 (2012?门头沟区一模)X、Y、Z、M、N五种常见的短周期元素原子半径随原子序数变化如图.已知X的一种原子的质量数为18,中子数为10;Y和Ne原子的核外电子数相差1;M的单质是一种常见的半导体材料;N的原子半径在同周期主族元素中最小;Y、Z、N三种元素的最高氧化物对应的水化物两两之间可以发生反应.下列说法错误的是( )
(2012?门头沟区一模)X、Y、Z、M、N五种常见的短周期元素原子半径随原子序数变化如图.已知X的一种原子的质量数为18,中子数为10;Y和Ne原子的核外电子数相差1;M的单质是一种常见的半导体材料;N的原子半径在同周期主族元素中最小;Y、Z、N三种元素的最高氧化物对应的水化物两两之间可以发生反应.下列说法错误的是( )