
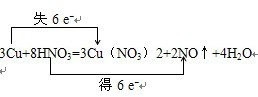
 ,当3mol金属铜参加反应时,转移电子6mol,所以若有1.5molCu发生了反应,则转移的电子的物质的量为3mol,即3NA=1.806×1024个,故答案为:
,当3mol金属铜参加反应时,转移电子6mol,所以若有1.5molCu发生了反应,则转移的电子的物质的量为3mol,即3NA=1.806×1024个,故答案为: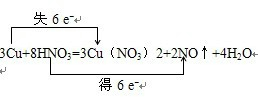 ;1.806×1024.
;1.806×1024.

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东梅州市某重点中学高一上学期期中考试化学试卷(带解析) 题型:计算题
(9分)在反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O中,有19.2gCu被氧化,则被还原的HNO3的质量为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com