
【题目】![]() 和
和![]() 催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意图如图(图中球棍模型中的“棍”可表示单键、双键或叁键),已知:
催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意图如图(图中球棍模型中的“棍”可表示单键、双键或叁键),已知:![]() ,下列说法不正确的是( )
,下列说法不正确的是( )

A.反应①为吸热反应,且![]()
B.催化剂![]() 对反应①和反应②都有催化作用
对反应①和反应②都有催化作用
C.反应②过程中既有碳氧键的断裂,也有碳氧键的形成
D.反应②的活化能为![]() ,反应焓变
,反应焓变![]()
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图所示:若关闭I阀,打开Ⅱ阀,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开I阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂不可能是()
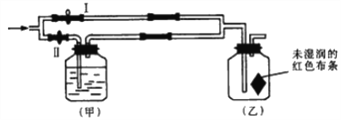
A. 浓H2SO4 B. Ba(OH)2溶液 C. NaCl溶液 D. NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.0 | 5.9 | 3.7 |
完全沉淀 | 3.5 | 8.4 | 4.7 |
请回答下列问题:
(1)该工艺中“搅拌”的作用是__,写出反应I中发生氧化还原反应的离子方程式__。
(2) “滤渣”的主要成分是__(填化学式),加入适量NaHCO3的目的是调节pH在__范围内。
(3)反应Ⅱ中加入NaNO2的离子方程式为__,在实际生产中,可以同时通入O2以减少NaNO2的用量,若参与反应的O2有5.6L(标况),则理论上相当于节约NaNO2(Mr=69)用量__g。
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解为Fe2(OH)![]() 聚合离子,该水解反应的离子方程式为__。
聚合离子,该水解反应的离子方程式为__。
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:取25.00mL溶液,稀释到250mL,准确量取20.00mL于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用0.01000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。已知:2Fe3++2I-==2Fe2++I2、2![]() +I2==2I-+
+I2==2I-+![]()
则溶液中铁元素的总含量为__g·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳族元素的单质及其化合物在生产、生活中是一类重要物质。请回答下列问题
(1)碳原子核外有__种不同运动状态的电子,第一电离能介于硼和碳之间的元素的名称为__,碳族元素外围电子排布的通式为__。
(2)青蒿素(C15H22O5)的结构如图所示,图中数字标识的五个碳原子的杂化轨道类型为__,组成青蒿素的三种元素电负性由大到小排序是__。
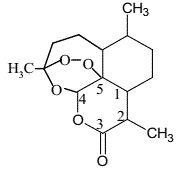
(3)青蒿素分子中,氧元素的成键方式有___;从青蒿中提取青蒿素的最佳溶剂是___。
a.乙醇 b.乙醚 c.水
(4)SnO2是一种重要的半导体传感器材料,用来制备灵敏度高的气敏传感器,SnO2与熔融NaOH反应生成Na2SnO3,Na2SnO3中阴离子空间构型为__。
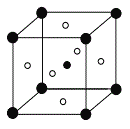
(5)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(CH3NH3PbI3,相对分子质量为Mr)半导体作为吸光材料,CH3NH3PbI3具有钙钛矿(AMX3)的立方结构,其晶胞如图所示。AMX3晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则X处于__位置。CH3NH3PbI3晶体的晶胞参数为anm,其晶体密度为dg·cm-3,则阿伏加德罗常数的值NA的计算表达式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.由三种元素组成的难溶化合物![]() 是一种新型超薄二维纳米材料,可用作锂电池的正极材料。可按如下流程探究
是一种新型超薄二维纳米材料,可用作锂电池的正极材料。可按如下流程探究![]() 的组成(已知
的组成(已知![]() 与稀盐酸恰好完全反应,且溶液
与稀盐酸恰好完全反应,且溶液![]() 与
与![]() 溶液作用显血红色)。
溶液作用显血红色)。
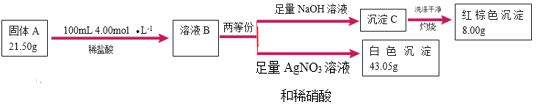
(1)![]() 中非金属元素是________,
中非金属元素是________,![]() 的化学式是________。
的化学式是________。
(2)固体![]() 与稀盐酸反应的离子方程式是________。
与稀盐酸反应的离子方程式是________。
(3)![]() 、化合物
、化合物![]() 、有机溶剂(可传导
、有机溶剂(可传导![]() )组成电池,放电时正极生成金属单质和两种含锂的化合物。放电时正极的电极反应式为________。
)组成电池,放电时正极生成金属单质和两种含锂的化合物。放电时正极的电极反应式为________。
Ⅱ.草酸亚铁![]() 是一种难溶于水的淡黄色结晶性粉末,可用于照相显影剂和制药工业。某小组为了检测草酸亚铁中铁元素价态,进行如下实验:取适量样品于试管中,加稀硫酸溶解,滴加适量酸性
是一种难溶于水的淡黄色结晶性粉末,可用于照相显影剂和制药工业。某小组为了检测草酸亚铁中铁元素价态,进行如下实验:取适量样品于试管中,加稀硫酸溶解,滴加适量酸性![]() 溶液,发现
溶液,发现![]() 溶液褪色,说明样品中有二价铁。
溶液褪色,说明样品中有二价铁。
(1)上述实验方案是否科学?说明理由________。
(2)请提出改进的实验方案________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:
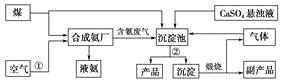
请回答下列问题:
(1)工艺操作①、②分别为____________、____________。
(2)工业合成氨的化学方程式为:__________。
(3)写出生成“产品”的离子方程式:________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。
(5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是人类获取能量的中重要途径
(1)液化气是一种重要的家庭燃料,下列示意图与液化气在燃烧过程中的能量变化最相符的是(______)
A.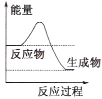 B.
B.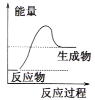 C.
C.
(2)"冰袋"可用于短时间保鲜食物。将一定量的碳酸钠晶体与硝酸铵晶体密封于一塑料袋中,用线绳绑住塑料袋中间那部分,使两种晶体分开,做成“冰袋”。使用时将线绳解下,用手将袋内两种固体粉末充分混合,便立即产生低温。由此判断:碳酸钠晶体与硝酸铵晶体的总能量_____(填“高于”或“低于”)反应后生成物的总能量
(3)化学反应中的能量变化不仅仅表现为热量的变化,有时还可以表现为其他形式的能量变化。比如,蜡烛燃烧可用来照明,这个过程是将化学能转化为______和_____;人们普遍使用的干电池工作时是将化学能转化为_____
(4)下列反应中,属于放热反应的是____,属于吸热反应的是_____。
①煅烧石灰石(主要成分是CaCO3)制生石灰(CaO) ②燃烧木炭取暖
③炸药爆炸 ④酸与碱的中和反应
⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(5)已知拆开1molH2中的化学键要吸收436kJ的能量,拆开1molO2中的化学键要吸收496kJ的能量,形成水分子中的1molH—O键要放出463 kJ的能量,试计算2H2+O2=2H2O反应中的ΔH=___kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应不仅用于焊接钢轨,而且还常用于冶炼熔点较高的金属如钒、铬、锰等。
请配平下列用铝热反应冶炼金属钒和钴的化学方程式,指出哪些物质是还原剂、哪些物质是氧化剂,并计算生成1 mol各种金属分别需要纯铝的质量。
V2O5+Al——Al2O3+V Co3O4+Al——Al2O3+Co
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、0族元素除外)( )

A. 4xB. 4x+14
C. 4x+10D. 4x+6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com