
【题目】某同学设计如下实验方案,以分离NaCl和BaCl2两种固体混合物,回答下列问题:
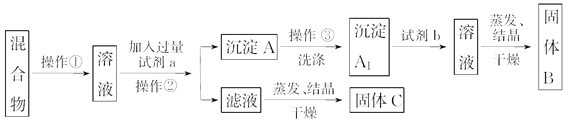
供选试剂:Na 2CO3溶液、Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作②的名称是______________。
(2)试剂a是________(填化学式,下同),试剂b是____________,固体B是________。
(3)加入试剂a所发生的化学反应方程式为_______________________________________。
(4)简述洗涤的操作步骤____________________________________________________________。
(5)该方案能否达到实验目的?___________。若不能,应如何改进(若能,此问不用回答)________。
【答案】 过滤 Na 2CO3 HCl BaCl2 BaCl2+ Na 2CO3=BaCO3↓+ 2NaCl 待滤液流尽后,向过滤器中加入少量蒸馏水至刚好浸没沉淀,静置,使洗涤液自然流下。重复上述操作2~3次 不能 向过滤后的滤液中加入适量盐酸至不再有气泡冒出。
【解析】试题分析:本题以分离NaCl和BaCl2的固体混合物为载体,考查除杂试剂的选择,基本实验操作,实验方案的评价和改进。根据实验方案和题目提供的试剂,试剂a为Na2CO3溶液,将BaCl2转化为BaCO3沉淀,操作②为过滤,过滤后得到的滤液中含有NaCl和过量的Na2CO3。沉淀A经洗涤除去可溶性杂质后获得的沉淀A1为BaCO3,BaCO3溶于盐酸又生成BaCl2,试剂b为盐酸,将BaCl2溶液蒸发结晶、干燥得到的固体B为BaCl2。
(1)操作②是将沉淀和滤液分离,操作②为过滤。
(2)根据上述分析,试剂a是Na2CO3溶液,试剂b是HCl,固体B是BaCl2。
(3)加入试剂a所发生的化学反应方程式为BaCl2+Na2CO3=BaCO3↓+2NaCl。
(4)洗涤的操作步骤:待滤液流尽后,向过滤器中加入少量蒸馏水至刚好浸没沉淀,静置,使洗涤液自然流下,重复上述操作2~3次直至洗净。
(5)由于操作②过滤得到的滤液中含NaCl和过量的Na2CO3,若直接蒸发结晶、干燥,得到的固体C是仍含杂质Na2CO3的NaCl,上述实验方案不能达到实验目的。改进的方法是:向过滤后的滤液中加入适量盐酸至不再有气泡冒出,然后蒸发结晶、干燥。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】化学是你,化学是我,化学深入我们生活,下列说法正确的是
A. 木材纤维和土豆淀粉遇碘水均显蓝色
B. 食用花生油和鸡蛋清都能发生水解反应
C. 包装用材料聚乙烯和聚氯乙烯都属于烃
D. PX项目的主要产品对二甲苯属于饱和烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于0.2 mol·L-1的NaCl溶液,说法不正确的是
A. 500mL该溶液中,所含溶质的质量为5.85g
B. 取2.34gNaCl固体,放入250mL容量瓶,加水配成200mL溶液
C. 从1L该溶液中取出100mL,则取出的NaCl的物质的量为0.02 mol
D. 取该溶液10mL,加水稀释至100mL后,NaCl的物质的量浓度为0.02 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.碘酸钾是国家规定的食盐加碘剂B.无水乙醇常用于杀菌消毒
C.口服维生素C可以促进补铁剂吸收D.聚乙烯塑料制品可用于食品包装
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中,能大量共存的离子组是
A. K+、HCO3-、K+、SO42- B. Ba2+、NO3-、Cl-、Na+
C. Na+、Fe2+、SO42-、NO3- D. Ca2+、K+、CO32-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.化学反应的焓变与反应的途径有关
B.室温下,稀释0.1mol·L-1CH3COOH溶液,溶液的导电能力减弱
C.常温常压下,22.4L Cl2中含有的分子数为6.02×1023个
D.等质量的铜按a、b两种途径完全转化为Cu(NO3)2,途径a、b消耗的硝酸一样多
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过量的金属锌投入热浓硫酸中,下列判断正确的是
A. 金属锌表面因生成致密氧化膜而不反应
B. 会立即生成H2
C. 会立即生成SO2,且只生成SO2
D. 除了SO2外,还会有H2产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)选择下列实验方法分离物质,将分离方法的字母序号填在横线上。
A.过滤法 B.分液法 C.蒸馏法 D.结晶法 E.萃取法 F.蒸发
①________分离水和豆油的混合物;
②________从含有硝酸钾和少量氯化钾的混合溶液中获得硝酸钾:
③________分离饱和食盐水和沙子的混合物;
④________分离酒精和水的混合物。
(2)与16gO2所含原子总数相同的NH3标准状况下体积是______L;
(3)已知2L Al2(SO4)3溶液中c(Al3+)=3mol/L ,则c(SO42-)=_____,与3L______ mol/LNa2SO4中SO42-的物质的量浓度相等。
(4)同温同压下,同体积的NH3和H2S气体的质量比为________;同质量的NH3和H2S气体的体积比为________,其中含有的氢的原子个数比为_______;若NH3和H2S的氢原子数相等,它们的体积比为_____________。
(5)在标准状况下,CH4和CO的混合气体共8.96L,二者对氢气相对密度是9.5,混合气体平均摩尔质量为_____,混合气体CH4的体积为 ______,一氧化碳的物质的量为_____,二者原子个数比为__________。
(6)某状况下气体摩尔体积为VmL/mol,将aLNH3溶解于水形成bmL氨水溶液,所得溶液的密度为![]() ,则氨水的物质的量浓度为_______。(写最简式)
,则氨水的物质的量浓度为_______。(写最简式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com