
【题目】常温下,下列四种酸溶液,能跟铝片反应放出H2且反应速率最快的是
A. 20mL 18.4mol·L1的硫酸溶液 B. 10mL 3mol·L1的硫酸溶液
C. 20mL 5mol·L1的盐酸溶液 D. 30mL 4mol·L1的硝酸溶液
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:
【题目】苯酚是一种重要的化工原料。以苯酚为主要起始原料,某种药物中间体M的合成路线如图:
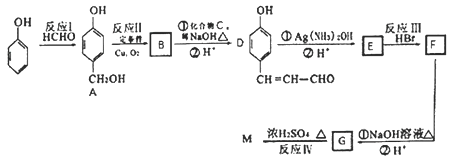
已知①![]()
②本题不考虑酚羟基与银氨溶液的中和反应
③M的结构中含有三个六元环
(1) D中含氧官能团的名称为________。
(2)化合物A的名称是________,M的结构简式为________。
(3)上述合成路线中属于加成反应的有________处。
(4)E→F的过程中可能有另一种产物F1,写出在加热条件下F1与足量稀NaOH溶液水溶液在加热条件下反应的化学方程式________。
(5)B与HCHO在一定条件下反应生成高分子化合物的原理,与酚醛树脂的制备原理相似,写出该反应的化学方程式________。
(6)满足下列条件的E的同分异构体有________种(不考虑立体异构)。
①能发生水解反应;②遇FeCl3溶液显紫色;③能发生银镜反应:④只含一个环状结构。其中核磁共振氢谱中有5组峰,且峰面积之比为1:2:2:2:1的结构简式为________。
(7)参照上述合成路线,设计一条以化合物C为原料,选用必要的无机试剂制备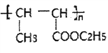 的合成路线:(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)________。
的合成路线:(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是( )
A. 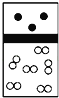 B.
B. 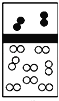 C.
C. 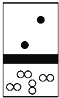 D.
D. 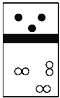
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】福酚美克是一种影响机体免疫力功能的药物,可通过以下方法合成:
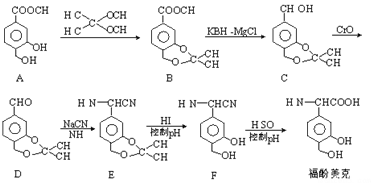
(1)B中的含氧官能团有______________和______________(填名称)。
(2)C→D的转化属于_______________反应(填反应类型)。
(3)已知E→F的转化属于取代反应,则反应中另一产物的结构简式为_______________。
(4)A(C9H10O4)的一种同分异构体X满足下列条件:
Ⅰ.X分子有中4种不同化学环境的氢。
Ⅱ.X能与FeCl3溶液发生显色反应。
Ⅲ.1molX最多能与4molNaOH发生反应。
写出该同分异构体的结构简式:_______________。
(5)已知: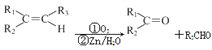 ,根据已有知识并结合相关信息,写出以
,根据已有知识并结合相关信息,写出以![]() 为原料制备
为原料制备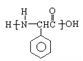 的合成路线流程图(无机试剂任用)______。
的合成路线流程图(无机试剂任用)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于加成反应的是 ( )
A. 甲烷与氯气反应生成油状液滴
B. 乙烯使溴的四氯化碳溶液褪色
C. 乙烯使酸性高锰酸钾溶液褪色
D. 苯燃烧时火焰明亮并带有浓烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.18g/ml,质量分数为36.5%浓盐酸配制250ml0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250ml0.1mol/L的盐酸溶液.应量取盐酸体积_________ml,应选用容量瓶的规格__________________ml。
(2)配制时,其正确的操作顺序是________。
A.用30ml水洗涤烧杯 2﹣3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30ml),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250ml的容量瓶中
D.将容量瓶盖紧、振荡、摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1﹣2cm处
a.BCAFED b.BCFED c.BCAED
(3)操作B中,使用量筒量取液体时视线俯视会造成配制液体浓度__________(偏高、偏低或无影响)。操作E中加水超过刻度线该如何处理?____________
(4)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响)?
a.没有进行A操作____________;
b.加蒸馏水时不慎超过了刻度___________;
c.定容时俯视_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于平衡常数K的说法中,正确的是( )
A.平衡常数K只与反应本身及温度有关
B.改变反应物浓度或生成物浓度都会改变平衡常数K
C.加入催化剂可以改变平衡常数K
D.在任何条件下,化学平衡常数是一个恒定值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组拟用小颗粒状铝硅合金与足量稀硫酸的反应(已知硅与稀硫酸不反应),测定通常状况(20℃,101 kPa)下的气体摩尔体积。拟选用下列实验装置完成实验:

(1)该小组同学必须选用的装置依次连接的合理顺序为A、_____________。
(2)实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,开始时稀硫酸能滴人锥形瓶中,一段时间后稀硫酸不能顺利滴入锥形瓶中,其原因是____________________。
(3)金属铝与稀硫酸反应的离子方程式为_________________。
(4)实验结束时,测量实验中生成H2体积的操作方法是_______________。
(5)实验中准确测得3个数据:实验前铝硅合金的质量m1g,实验后残留固体的质量m2g,实验后量筒中液面读数为V ml。。则通常状况下气体摩尔体积Vm=__________L·mol-l。若合金中含少量铜,则所测得的Vm将____________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com