
| A. | 钢铁发生电化腐蚀的正极反应式:Fe-2e-=Fe2+ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH- | |
| C. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ | |
| D. | 锌铜原电池中,锌做负极,发生还原反应 |
分析 A.负极Fe失去电子;
B.正极上氧气得到电子;
C.用惰性电极电解饱和食盐水时,阳极上氯离子失去电子;
D.锌铜原电池中,活泼金属作负极,失去电子发生氧化反应.
解答 解:A.钢铁发生电化腐蚀的负极反应式为Fe-2e-=Fe2+,析氢腐蚀时正极上氢离子得到电子,吸氧腐蚀时正极上氧气得到电子,故A错误;
B.电解质为碱时,氢氧燃料电池的正极反应式为O2+2H2O+4e-=4OH-,电解质为酸时,正极反应为O2+OH++4e-=2H2O,故B错误;
C.用惰性电极电解饱和食盐水时,阳极时氯离子失去电子,阳极的电极反应式为2Cl--2e-=Cl2↑,故C正确;
D.锌铜原电池中,锌做负极,发生氧化反应,故D错误;
故选C.
点评 本题考查原电池及金属的腐蚀与防护,为高频考点,把握原电池原理、电极反应及原电池的应用为解答的关键,侧重分析与应用能力的考查,注意电极反应的书写,题目难度不大,


科目:高中化学 来源: 题型:选择题
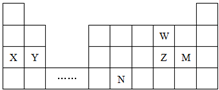
| A. | 原子半径:X>Y>W | |
| B. | 单质的氧化性:W>Z | |
| C. | 溴与元素M同主族,气态氢化物的稳定性比M的强 | |
| D. | 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
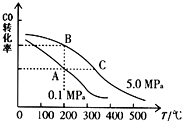 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
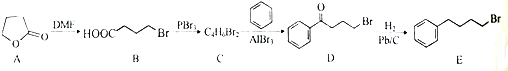
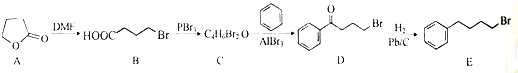
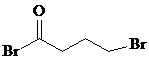 ;由C→D的反应类型是取代反应.
;由C→D的反应类型是取代反应.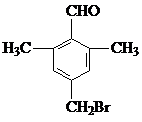 等.
等.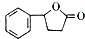 的合成路线流程图(无机试剂任用).合成路线流程图示例如下
的合成路线流程图(无机试剂任用).合成路线流程图示例如下查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .(不考虑空间构型)
.(不考虑空间构型)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=Q kJ•mol-1
工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=Q kJ•mol-1| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
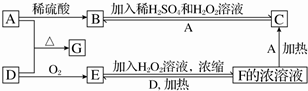
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH+3O2$\stackrel{点燃}{→}$2CO2+3H2O | |
| B. | CH3OH+HCl→CH3Cl+H2O | |
| C. | (NH4)2SO4+BaCl2═BaSO4↓+2NH4Cl | |
| D. | CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com