
| A. | υ(A)=0.20mol/(L•min) | B. | υ(B)=0.45 mol/(L•min) | ||
| C. | υ(C)=0.30 mol/(L•min) | D. | υ(D)=0.35 mol/(L•min) |
分析 不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的反应速率越快,注意单位保持一致.
解答 解:不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的反应速率越快,
A.$\frac{v(A)}{1}$=0.20mol/(L•min);
B.$\frac{v(B)}{3}$=0.15mol/(L•min);
C.$\frac{v(C)}{2}$=0.15mol/(L•min);
D.$\frac{v(D)}{2}$=0.175mol/(L•min),
故反应速率v(A)>v(D)>v(B)=v(C),
故选A.
点评 本题考查化学反应速率快慢比较,比较基础,利用比值法可以快速判断,也可以转化为同一物质表示的速率进行比较.


科目:高中化学 来源: 题型:多选题
| A. | 25.0mL | B. | 35.0mL | C. | 17.5mL | D. | 7.5mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
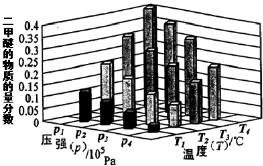
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2gH2,则电路通过电子0.4NA | |
| B. | 18gD2O中含有的质子数目为10NA | |
| C. | 1molCl2发生反应时,转移的电子数一定是2NA | |
| D. | 常温常压下,16gO3所含的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 | |
| B. | 碘水与碘化钾淀粉试纸作用出现蓝色,说明碘具有氧化性 | |
| C. | 往饱和Na2CO3溶液中通入CO2有固体析出,说明NaHCO3溶解度小于Na2CO3 | |
| D. | 同温下,等物质的量浓度的Al2(SO4)3比MgSO4溶液的pH小,说明镁比铝的金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一个小黑点表示一个电子 | B. | 黑点的多少表示电子个数的多少 | ||
| C. | 表示电子运动的轨迹 | D. | 电子在核外空间出现机会的多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
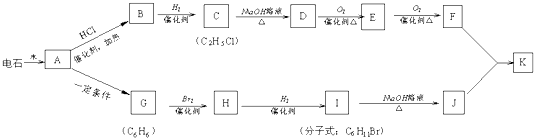
 ;
;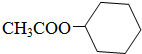 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
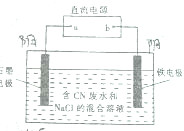 工业上,在强碱性条件下用电解法除去废水中的CN-,装制如图所示,依次发生的反应有:
工业上,在强碱性条件下用电解法除去废水中的CN-,装制如图所示,依次发生的反应有:| A. | a是电源的正极 | |
| B. | 铁电极上发生的电极反应式为2H++2e-═H2↑ | |
| C. | 为了使电解池连续工作,需要不断补充NaOH | |
| D. | 除去1mol CN-,电解过程中共产生标准状况下11.2L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力. 、④HCHO等,其中分子属于平面结构的有①②③④(填物质序号),预测HCHO分子的立体结构为平面三角形.
、④HCHO等,其中分子属于平面结构的有①②③④(填物质序号),预测HCHO分子的立体结构为平面三角形.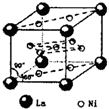 ,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上.该晶体的化学式为Ni5La或LaNi5.
,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上.该晶体的化学式为Ni5La或LaNi5.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com