
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如表所示反应:
①2NO(g)+Cl2(g)2ClNO(g)△H1<0,平衡常数为 K1;
②2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)△H2<0,平衡常数为 K2。
(1)4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)△H3,平衡常数 K=______(用 K1、K2 表示)。△H3=_________(用△H1、△H2 表示)。
(2)①为研究不同条件对反应①的影响,在恒温条件下,向 2 L 恒容密闭容器中加入0.2 mol NO 和 0.1 mol Cl2,10 min 时反应①达到平衡。测得 10 min 内 v(ClNO)=7.5×10-3molL-1min-1,则平衡后 n(Cl2)=__________mol,NO 的转化率α1=__________。
②其他条件保持不变,反应①在恒压条件下进行,平衡时 NO 的转化率为α2,α1 ________α2(填“>”“<”或“=”),平衡常数 K1 ________ (填“增大”“减小”或“不变”)。若要使 K1 减小,可采用的措施是 ________。
【答案】![]() 2H2﹣△H1 0.025 75% < 不变 升高温度
2H2﹣△H1 0.025 75% < 不变 升高温度
【解析】
(1)已知:①NO(g)+Cl2(g)2ClNO(g),②2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g),根据盖斯定律,②×2-①可得:4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g),则该反应平衡常数为②平衡常数平方与a①的商;
(2)①测得10min内v(ClNO)=7.5×10-3molL-1min-1,则△n(ClNO)=7.5×10-3molL-1min-1×10min×2L=0.15mol,由方程式计算参加反应NO、氯气的物质的量,进而计算平衡时氯气的物质的量、NO的转化率;正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应a在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动;
②平衡常数只受温度影响,温度不变,平衡常数不变,正反应为放热反应,升高温度平衡逆向移动,平衡常数减小。
(1)已知:①NO(g)+Cl2(g)2ClNO(g),
②2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g),
根据盖斯定律,②×2-①可得:4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g),则该反应平衡常数K=![]() ,则△H3=2H2-△H1,故答案为:
,则△H3=2H2-△H1,故答案为:![]() ;2H2-△H1;
;2H2-△H1;
(2)①测得10min内v(ClNO)=7.5×10-3molL-1min-1,则△n(ClNO)=7.5×10-3molL-1min-1×10min×2L=0.15mol,由方程式可知,参加反应氯气的物质的量为0.15mol×![]() =0.075mol,故平衡时氯气的物质的量n(Cl2)=0.1mol-0.075mol=0.025mol;参加反应NO物质的量为0.15mol,则NO的转化率为
=0.075mol,故平衡时氯气的物质的量n(Cl2)=0.1mol-0.075mol=0.025mol;参加反应NO物质的量为0.15mol,则NO的转化率为![]() ×100%=75%;故答案为:0.025;75%;
×100%=75%;故答案为:0.025;75%;
②正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,a在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动,NO转化率增大,故转化率α1<α2;
平衡常数只受温度影响,温度不变,平衡常数不变,正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,故答案为:<;不变;升高温度。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】50mL0.50mol·L-1盐酸与50mL0.55 mol·L -1NaOH 溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是

A. 在测定中和热的实验中,至少需要测定并记录的温度是3次
B. 大烧杯上如不盖硬纸板,测得的中和热数值会偏小
C. 用相同浓度和体积的氨水代替NaOH 溶液进行上述实验,测得中和热的数值会偏大
D. 从实验装置上看,除了缺少环形玻璃搅拌棒外没有其他问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积为2 L的密闭容器中加入2 molA和3 molB,保持温度为30℃,在催化剂存在的条件下进行下列反应:2A(g)+3B(g) ![]() 3C(g),2分钟达到平衡,生成1.5 mol C,此时,平衡混合气中C的体积分数为ω1;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol,体积分数为ω2,请回答下列问题,
3C(g),2分钟达到平衡,生成1.5 mol C,此时,平衡混合气中C的体积分数为ω1;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol,体积分数为ω2,请回答下列问题,
(1)该反应在30℃时平衡常数K1=_________ ,焓变△H_______0(填“>”、“<”或“=”)。
(2)从反应开始到达到化学平衡状态v(A)____________mol/(L·min)
(3)该反应在70℃时平衡常数为K2,则 K1_______K2(填“>”、“=”或“<”)
(4)可以判断2A(g)+3B(g) ![]() 3C(g) 反应已经达到平衡(____)
3C(g) 反应已经达到平衡(____)
A.2v(B)=3v(A)
B.密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变
D.混合气体的平均相对分子质量不再改变
E.n(A)∶n(B)∶n(C)=2∶3∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸亚铁((C6H11O7)2Fe)是常用的补铁剂,易溶于水,几乎不溶于乙醇。用下图装置制备FeCO3,并利用FeCO3与葡萄糖酸反应可得葡萄糖酸亚铁。回答下列问题:

(1)a的名称为_________。
(2)打开a中K1、K3,关闭K2,一段时间后,关闭K3,打开K2。在_________(填仪器标号)中制得碳酸亚铁。实验过程中产生的H2作用有_________、____________。(写2条)
(3)将制得的碳酸亚铁浊液过滤、洗涤。如过滤时间过长会发现产品部分变为红褐色。用化学方程式说明原因____________。
(4)将葡萄糖酸与碳酸亚铁混合,加入乙醇、过滤、洗涤、干燥。加入乙醇的目的是_________________。
(5)用 NaHCO3溶液代替Na2CO3溶液制备碳酸亚铁,同时有气体产生,离子方程式为______________,此法产品纯度更高,原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。已知:铟与铝(13Al)同主族。下列说法错误的是( )
A.In的金属性大于Al
B.In最外层有2种能量的电子
C.![]() In的中子数为66
In的中子数为66
D.![]() In原子的相对原子质量为115
In原子的相对原子质量为115
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温条件下,欲使CH3COONa的稀溶液中![]() 比值增大,可在溶液中加入少量下列物质中的( )
比值增大,可在溶液中加入少量下列物质中的( )
①固体NaOH ②固体KOH ③固体NaHSO4 ④固体CH3COONa ⑤冰醋酸
A.只有①②B.只有③⑤C.只有②④⑤D.只有①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中,有反应mA(g)+nB(g)![]() pC(g)+qD(g),经过5 min达到平衡,此时各物质的变化为A物质的量浓度减少amol·L-1,B的平均反应速率v(B)=a/15 mol·L-1·min-1,C物质的量浓度增加2a/3 mol·L-1,这时若增大系统压强,发现A与C的百分含量不变,则m∶n∶p∶q为( )
pC(g)+qD(g),经过5 min达到平衡,此时各物质的变化为A物质的量浓度减少amol·L-1,B的平均反应速率v(B)=a/15 mol·L-1·min-1,C物质的量浓度增加2a/3 mol·L-1,这时若增大系统压强,发现A与C的百分含量不变,则m∶n∶p∶q为( )
A.3∶1∶2∶2B.1∶3∶2∶2C.3∶1∶2∶1D.1∶1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1799年,英国化学家汉弗莱·戴维发现了N2O气体。在食品行业中,N2O可用作发泡剂和密封剂。
(1)N2O是硝酸生产中氨催化氧化的副产物,NH3与O2在加热和催化剂的作用下生成N2O的化学方程式为_________。
(2)N2O在金粉表面发生热分解反应:2N2O(g) =2N2(g)+O2(g) △H。
已知:2NH3(g) + 3N2O(g) = 4N2(g) + 3 H2O(l) △H1
4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(l) △H2
△H= _________(用含△H1、△H2的代数式表示)。
(3)N2O和CO是环境污染性气体,这两种气体会发生反应:N2O(g)+CO)(g)CO2(g)十N2(g),“Fe+”常用作该反应的催化剂。 其总反应分两步进行:
第一步为Fe+ +N2OFeO+ +N2;第二步为________(写化学方程式)。
第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第二步反应活化能_______ (填“大于”“小于”或“等于”)第一步反应活化能。
(4)在四个恒容密闭容器中充入相应量的气体(图甲),发生反应2N2O(g)2N2(g)+O2(g) △H,容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图乙所示:

①该反应的△H________(填“>”或“<”)0。
②容器Ⅱ的体积为5L,在470℃下进行反应,30s后达到平衡,0~30s内容器Ⅱ中O2的反应速率为_________mol.L-1.min-1 ;容器Ⅳ的体积为1L,容器Ⅳ中的物质也在470℃下进行反应,起始反应速率:![]() 正(N2O)_______
正(N2O)_______![]() 逆(N2O)。(填“>”“<”或“=”)
逆(N2O)。(填“>”“<”或“=”)
③图中A、B、C三点处容器内密度最大的点是_________(填“A”“B”或“C”)。
④已知容器Ⅰ的体积为10L,370℃时,该反应的平衡常数k=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯仿(CHC13)是无色透明液体,不溶于水和浓硫酸,溶于醇,沸点为61.2℃,工业品氯仿中常含有少量乙醇。某校同学设计实验制备少量氯仿。
(1)甲组同学设计下列装置用干燥纯净的氯气制备实验原料漂白粉[已知:3Ca(ClO)2 ![]() Ca(ClO3)2+2CaCl2 △H>0]。
Ca(ClO3)2+2CaCl2 △H>0]。

①各仪器接口连接顺序为____(气流白左至右,用小写字母表示)。
②装置B中发生反应的离子方程式为 ___。
③装置A用冰水冷却的目的是____。
(2)乙组同学用甲组制得的漂白粉与乙醇溶液反应制备氯仿的实验装置如图。
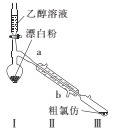
①装置I需控制温度约为70℃,适宜的加热方式是 ___,温度不宜过高,其目的是____。
②装置Ⅱ的名称是____。
③一定条件下,装置I中漂白粉先与乙醇溶液反应生成Cl2和Ca(OH)2,然后Cl2与CH3CH2OH反应生成CCl3CHO,CCl3CHO再与Ca(OH)2反应生成CHC13和一种盐,CCl3CHO与Ca(OH)2反应的化学方程式为 _________。
(3)丙组同学用下列方法对乙组制得的粗产品进行提纯。已知浓硫酸能与乙醇混溶。
步骤I.向粗产品中加入适量浓硫酸,搅拌至呈淡咖啡色,分液得有机层;
步骤Ⅱ.用15%的Na2CO3溶液洗涤多次,分液得有机层;
步骤Ⅲ.向有机层中加入少量无水CaCl2。
步骤I中用浓硫酸洗涤的目的是____;步骤Ⅱ中证明已洗涤干净的依据是____;步骤Ⅲ中加入少量无水CaCl2的目的是 ___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com