

分析 (1)N原子核外有7个电子,最外层有5个电子,根据构造原理顺序其价电子排布式;
(2)同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素;
(3)①根据价层电子对互斥理论确定分子空间构型和原子的杂化方式;
②反应中有4mol N-H键断裂,生成1.5molN2,根据结构式N≡N判断;
③根据硫酸铵晶体中存在的化学键判断;
(4)嵌入某微粒分别与4个N原子形成4个氢键.
解答 解:(1)氮原子的电子排布式1s22s22p3,其价层电子排布式为2s22p3,
故答案为:2s22p3;
(2)C、N、O属于同一周期元素且原子序数依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是N>O>C,
故答案为:N>O>C;
(3)①NH3分子中氮原子含有3个共价键和一个孤电子对,所以空间构型是三角锥型;N2H4分子中氮原子的价层电子对=3+1=4,含有一个孤电子对,N原子轨道的杂化类型是sp3,
故答案为:三角锥型;sp3;
②N2O4+2N2H4═3N2+4H2O,若该反应中有4mol N-H键断裂,即有1mol N2H4参加反应,生成1.5mol N2,形成π键的物质的量为2×1.5mol=3mol,
故答案为:3;
③3N2H6SO4和(NH4)2SO4都是离子晶体,N2H6 2+和SO42-之间存在离子键,N2H62+中N和H之间形成6个共价键(其中2个配位键),N和N之间形成共价键,SO42-中S和O之间形成共价键,不含范德华力,
故选:d;
(4)由氢键的形成条件及成键元素(N、O、F、H)可知,本题中嵌入某微粒分别与4个N原子形成4个氢键,由成键元素及数目可知为NH4+,
故答案为:c.
点评 本题考查了价电子排布式、元素第一电离能大小比较、分子空间构型的判断、原子的杂化方式的判断等知识点,题目难度中等,注意分子空间构型的判断及原子杂化方式的判断是高考的热点.


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在25℃、1.01×105Pa的条件下,22.4L H2中含有的分子数为0.1NA | |
| B. | 1L 1mol•L-1的CaCl2溶液中含Cl-的数目为2NA | |
| C. | 40g NaOH溶解在1L水中,所制得的100mL溶液中含Na+数为0.1NA | |
| D. | 22g CO2与标准状况下11.2L H2O含有相同分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NH3•H2O
NH3•H2O NH4++OH-.
NH4++OH-.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 质子透过离子交换膜由右向左移动 | |
| B. | 铜电极应与X相连接 | |
| C. | M电极反应式:(C6H10O5)n+7nH2O-24ne-═6nCO2↑+24nH+ | |
| D. | 当N电极消耗0.2 mol气体时,则铁电极增重16g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+的基态电子排布图是: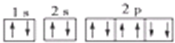 | |
| B. | 质量数之和是质子数之和两倍的水分子符号可能是:D${\;}_{2}^{1}$O | |
| C. | Na22的电子式: | |
| D. | 氯离子结构示意图为: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 反应:aA(g)+bB(g)cC(g)+dD(g)中A的转化率和含量符合如图所示变化关系,下列叙述中,正确的是.
反应:aA(g)+bB(g)cC(g)+dD(g)中A的转化率和含量符合如图所示变化关系,下列叙述中,正确的是.| A. | 压强P1比P2大 | B. | (a+b)比(c+d)大 | ||
| C. | 温度t1℃比t2℃低 | D. | 正反应为吸热反应. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b | B. | a<b | C. | a′>b′ | D. | a′=b′ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com