
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:实验题
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-═BaSO4↓ | |
| D. | 氧化镁与稀硫酸混合:MgO+2H+═Mg2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3CuS+8HNO3═3Cu(NO3)2+2NO↑+3S↓+4H2O | |
| B. | Br2+2KOH═KBr+KBrO+H2O | |
| C. | 3H2O2+2KCrO2+2KOH═2K2CrO4+4H2O | |
| D. | 3CCl4+K2Cr2O7═2CrO2Cl2+3COCl2+2KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向盛有1mL浓硫酸的试管中加入5mL 0.1mol•L-1 的 K2Cr2O7溶液 | 溶液橙色变深 | 増大生成物浓度,平衡Cr2O72-(橙色)+H2O?2CrO42- (黄色)+2H+逆向移 动 |
| B | 向Mg(OH)2悬浊液中加入少量 氯化铵晶体 | 沉淀溶解,溶液变澄清 | 说明反应Mg(OH)2+2NH4+?Mg2++2NH3•H2O具有可逆性 |
| C | 白铁皮(镀锌铁)出现刮痕后浸泡 在饱和食盐水中,一段时间后滴入几滴K3[Fe(CN)6]溶液 | 无明显现象 | 该过程未发生原电池反应 |
| D | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火 焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | Cl2通入NaOH溶液中:Cl2+OH-═Cl-+ClO-+H2O | |
| C. | 二氧化氮与水反应:3NO2+H2O═2H++2NO3-+NO | |
| D. | 往碳酸镁中滴加稀盐酸:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
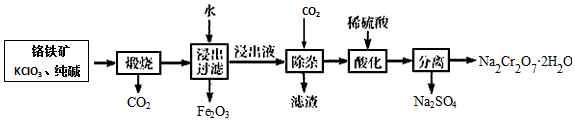
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾,在550℃时能被氧气氧化 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 严禁露天焚烧农作物秸秆 | |
| B. | 加强植树造林,增大绿化面积 | |
| C. | 大力推行汽车使用天然气或氢气为燃料 | |
| D. | 生产生活中加大煤炭和石油等燃料的使用量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com