
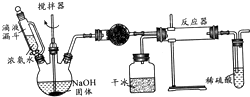
 实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)?NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵.
实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)?NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵.| 2×14 |
| 78 |
| 0.007mol |
| 0.01mol |


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
| A、pH相等的下列溶液①(NH4)2SO4、②NH4HSO4、③NH4Cl,c(NH4+)的大小关系为①=③>② |
| B、0.1mol/L的NaHA溶液,若pH=4,则溶液中存在:c(HA-)>c(H+)>c(H2A)>c(A2-) |
| C、在NaHCO3和Na2CO3的混合溶液中一定存在:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| D、在物质的量浓度之比为1:2的NaClO、NaHCO3的混合溶液中一定存在:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
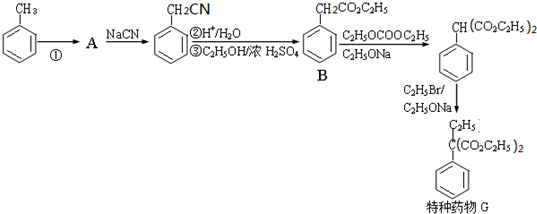
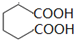 ,请设计合成路线(无机试剂及溶剂任选).
,请设计合成路线(无机试剂及溶剂任选).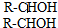
| pb(OAc)4 |
| H2/催化剂 |
| 加热加压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
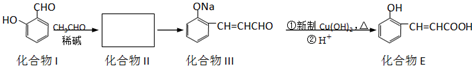
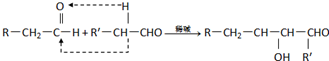
查看答案和解析>>
科目:高中化学 来源: 题型:
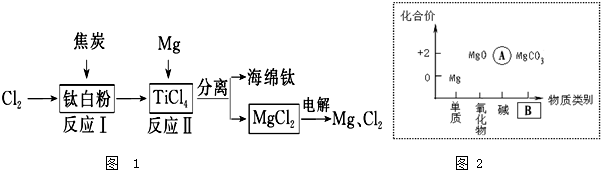
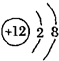 为镁元素的某种粒子结构示意图,该图表示(填序号)
为镁元素的某种粒子结构示意图,该图表示(填序号)
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| HCl |
| △ |
| O2/Cu |
| △ |
| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.6 g |
| B、7 g |
| C、2.8 g |
| D、8.4 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
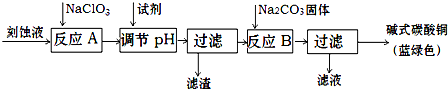
| 物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com