
| A. | 可用丁达尔现象区分溶液与胶体 | |
| B. | 生石灰与水混合的过程只发生物理变化 | |
| C. | O3是由3个氧原子构成的化合物 | |
| D. | CuSO4•5H2O是一种混合物 |
分析 A.胶体有丁达尔效应,溶液没有;
B.生石灰和水反应生成氢氧化钙,属于化学变化;
C.由同种元素组成的纯净物是单质;
D.混合物是不同物质组成的物质.
解答 解:A.胶体有丁达尔效应,溶液没有,故利用丁达尔效应可以区分溶液和胶体,故A正确;
B.生石灰和水反应生成氢氧化钙,反应方程式为CaO+H2O=Ca(OH)2,该变化属于化学变化,故B错误;
C.由同种元素组成的纯净物是单质,臭氧分子是由3个O原子构成,臭氧属于单质,故C错误;
D.CuSO4•5H2O只含一种物质,是纯净物,故D错误.
故选A.
点评 本题考查内容较多,涉及胶体、化学变化、物质的分类等,题目难度不大,学习中注意相关基础知识的积累.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | C6H11COOH | B. | C6H5COOH | C. | C6H10COOH | D. | C5H10CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
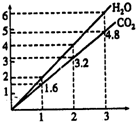 两种气态烃组成的混合气体,完全燃烧后得到C02和H2O的物质的量随着混合烃物质的量的变化如图所示.则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体,完全燃烧后得到C02和H2O的物质的量随着混合烃物质的量的变化如图所示.则下列对混合烃的判断正确的是( )| A. | 一定含有CH4 | B. | 一定含有C2H6 | C. | 一定含有C2H4 | D. | 一定不含有C3H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ Ba2+ Cl- SO42- | B. | K+ Na+ NO3- OH- | ||
| C. | H+ NH4+ Fe3+ SO42- | D. | H+ Cl- CO32- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表示没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式如图:有关EGCG的说法错误的是( )
美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表示没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式如图:有关EGCG的说法错误的是( )| A. | EGCG的分子式为C22H18O11 | |
| B. | EGCG在空气中易氧化,也能与溴水发生加成反应 | |
| C. | 1molEGCG最多可与含9mol氢氧化钠的溶液完全作用 | |
| D. | EGCG能与碳酸钠溶液反应,但不能放出二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol酸与碱恰好中和时所放出的热量叫中和热 | |
| B. | 化学反应中的能量变化,主要是由化学键的变化引起的 | |
| C. | 燃料电池反应时,化学能升高 | |
| D. | 反应物的总能量高于生成物总能量的反应,不需要加热就可自行反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com