
| 元素 | 相关结构和性质 |
| A | 其单质的一种晶体不是金属晶体,但是电的良导体,且难熔、质软并有润滑性,可用作原子核反应堆的慢化剂、火箭发动机喷灌和电极材料等。 |
| B | 其单质既能与强酸溶液反应,又能与强碱溶液反应,其简单离子在第三周期单核离子中半径最小。 |
| C | 是蛋白质的组成元素之一,原子核外有三种不同能量的电子,且未成对电子数最多。 |
| D | 原子核外最外层电子排布式为nsnnp2n+1 |
 NH3?H2O
NH3?H2O NH4++OH- (2分) (4)B
NH4++OH- (2分) (4)B 4Al+3O2↑。
4Al+3O2↑。 NH3?H2O
NH3?H2O NH4++OH-。
NH4++OH-。

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.依据元素的原子序数,推断该元素原子的核外电子数 |
| B.依据原子最外层电子数的多少,推断元素金属性、非金属性的强弱 |
| C.依据气体的摩尔质量,推断相同状态下不同气体密度的大小 |
| D.依据液体物质的沸点,推断将两种互溶液态混合物用蒸馏法分离的可行性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 键的数目之比为 。
键的数目之比为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
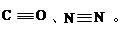 (2)CO、N2的结构可表示为:
(2)CO、N2的结构可表示为: | | A—B | A=B | 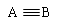 |
| CO | 357.7 | 798.9 | 1071.9 |
| N2 | 154.8 | 418.4 | 941.7 |
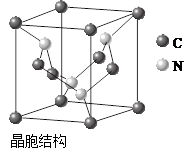
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

|

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com