
| m |
| M |
| 1.7g |
| 17g/mol |
| 0.4mol |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期主族元素A、B、C、D、E的原子序数依次增大,它们的原子核外层数之和为10;B的化合物种类繁多,数目庞大.C、D是空气中含量最多的两种元素;D、E两单质可以生成两种不同的离子化合物.
短周期主族元素A、B、C、D、E的原子序数依次增大,它们的原子核外层数之和为10;B的化合物种类繁多,数目庞大.C、D是空气中含量最多的两种元素;D、E两单质可以生成两种不同的离子化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
| 50-80℃ |
| 180-200℃ |
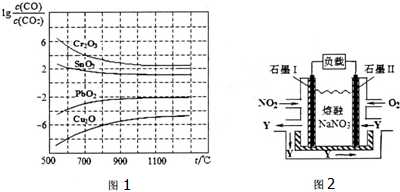
| 1 |
| 2 |
| c(CO) | ||
c(C
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、32 | B、16 | C、8 | D、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有NA个氧原子的氧气在标准状况下的体积约为22.4L |
| B、2L 0.3mol?L-1的硫酸钾溶液中钾离子浓度为1.2mol?L-1 |
| C、常温常压下,32g O2和O3的混合气体所含原子数为2NA |
| D、25℃,1.01×105Pa,64g SO2中含有的原子个数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com