
【题目】某有机化合物D的结构为 ![]() ,是一种常见的有机溶剂,它可以通过下列三步反应制得:烃A
,是一种常见的有机溶剂,它可以通过下列三步反应制得:烃A ![]() B
B ![]() C
C ![]() D,下列相关说法中正确的是( )
D,下列相关说法中正确的是( )
A.烃A为CH3CH3
B.反应②属于消去反应
C.反应①②③都属于取代反应
D.化合物D属于醚
【答案】D
【解析】解:由烃A ![]() B
B ![]() C
C ![]() D可知,烃A和溴发生加成反应生成B,则B中含有两个Br原子,B发生取代反应生成C,C为二元醇,C发生取代反应生成D,根据D结构简式知,C结构简式为HOCH2CH2OH,B发生取代反应生成C,B为CH2BrCH2Br,只能是乙烯和溴发生加成反应生成1,2﹣二溴乙烷,则A结构简式为CH2=CH2 ,
D可知,烃A和溴发生加成反应生成B,则B中含有两个Br原子,B发生取代反应生成C,C为二元醇,C发生取代反应生成D,根据D结构简式知,C结构简式为HOCH2CH2OH,B发生取代反应生成C,B为CH2BrCH2Br,只能是乙烯和溴发生加成反应生成1,2﹣二溴乙烷,则A结构简式为CH2=CH2 ,
A.通过以上分析知,A为CH2=CH2 , 故A错误;
B.通过以上分析知,反应②属于取代反应,故B错误;
C.通过以上分析知,反应①②③分别是加成反应、取代反应、取代反应,故C错误;
D.根据D结构简式知,D中含有醚键,所以属于醚,故D正确;
故选D.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】汽车尾气产生NO的反应为:N2(g)+O2(g)2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是( ) 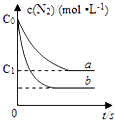
A.曲线b对应的条件改变可能是加入了催化剂
B.温度T下,随着反应的进行,混合气体的密度减小
C.温度T下,该反应的平衡常数K= ![]()
D.若曲线b对应的条件改变是温度,可判断该反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题: 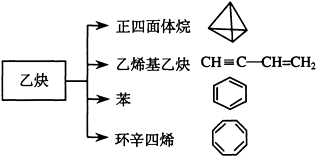
(1)正四面体烷的分子式为 , 其二氯取代产物有种
(2)关于乙烯基乙炔分子的说法错误的是:
a 能使酸性KMnO4溶液褪色
b 1摩尔乙烯基乙炔能与3摩尔Br2发生加成反应
c 生成乙烯基乙炔分子的反应属于取代反应
d 等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式:
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例):、
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图,a处通入Cl2,当打开b阀时,c处的干燥的红布条没有明显变化,当关闭b阀时.c处的干燥红布条逐渐褪色,则d瓶中装的溶液可能是
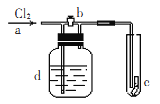
A. NaOH溶液 B. 饱和食盐水 C. Ca(OH)2溶液 D. 浓H2S04
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeS04,较多的Cu2+和少量Na+。该工厂计划从废水中回收FeS04和金属铜。根据下列流程图,同答问题。
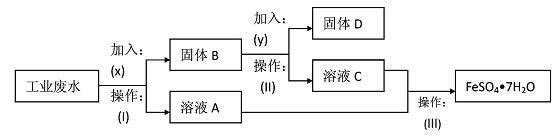
(1)加入的试剂x为____,y为____;
(2)加入试剂y发生反应的离子方程式是_______;
(3)操作(I)为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法对人体健康不会造成危害的是( )
A.用工业盐(NaNO2)作咸味调味品
B.用硫磺熏制银耳,使它颜色更白
C.食盐中加入一定量的碘酸钾(KIO3)制取加碘食盐
D.将含有甲醇(CH3OH)的工业酒精兑制成饮用白酒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了充分应用资源,用工业废碱液(Ca(OH)2、NaOH)与烟道气(回收成分SO2)来制取石膏(CaSO42H2O)和过二硫酸钠(Na2S2O8)。设计简要流程如图:
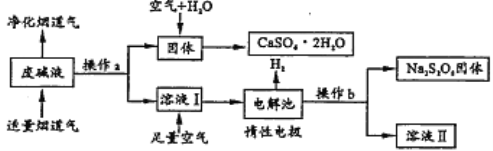
(1)烟道气中SO2与废碱生成沉淀的化学方程式为_____;操作a的名称是_____。
(2)生成CaSO42H2O过程中没有涉及到的化学反应类型为_____(填序号)。
A.复分解反应 B.化合反应 C.分解反应 D.氧化反应 E.置换反应
(3)溶液Ⅰ通入空气发生反应的化学方程式为_____。
(4)用惰性电极电解时,阳极生成Na2S2O8的电极反应为_____;在整个流程中可以循环利用的物质是H2O和_____(填化学式)。
(5)一定条件下将S8(s)、O2(g)、NaOH(s)转化过程中的能量关系用如图简单表示。则S8(s)燃烧的热化学反应方程式为_____。

(6)若制取ag Na2S2O8时,阳极有bL氧气(标况)产生。则电解生成的H2体积在标准状况下为_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在国民生产中占有重要的地位.工业合成氨的反应为:N2(g)+3H2(g)2NH3(g)△H=﹣92.4KJ/mol.请回答下列问题:
(1)表明合成氨反应处于平衡状态的是(填字母)
a.2v正(NH3)>3v逆(H2)b.c(N2)=c(H2)>c(NH3)
c.单位时间内有3molH﹣H键断裂,同时有6molN﹣H键断裂
d.恒温恒容时,容器内压强不变
e.恒温恒容时,容器内混合气体的弥补不变
(2)在一定条件下的密闭容器中,该反应达到平衡,既要加快反应速率,又要提高H2的转化率,可以采取的措施有(填字母)
a.升高温度 b.分离出液态氨气 c.增加N2浓度 d.增加H2浓度
(3)已知在400℃时,N2(g)+3H2(g)2NH3(g)的平衡常数K=0.5,则NH3(g)N2(g)+3H2(g)的平衡常数表达式为K= , 数值为 .
(4)有两个密闭容器A和B,A容器保持恒容,B容器爆出恒压,起始时向容积相等的A、B中分别通入等量的NH3气体,均发生反应:2NH3(g)3H2(g)+N2(g).则:
①达到平衡所需的时间:t(A)t(B),平衡时,NH3的转化率:a(A)a(B)(填“>”、“=”或“<”).
②达到平衡后,在两容器中分别通入等量的氦气.A中平衡向移动,B中平衡向移动.(填“向正反应方向”、“向逆反应方向”、“不”).
(5)在三个相同容器中各充入1molN2和3molH2 , 在不同条件下反应并达到平衡,氨的体积分数[Ψ(NH3)]随时间变化的曲线如图所示.下列说法中正确的是(填字母,下同). 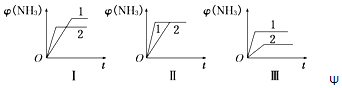
a.图Ⅰ可能是不同压强对反应的影响,且p2>p1
b.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2
c.图Ⅲ可能是不同温度对反应的影响,且T1>T2 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com