

分析 磷石膏氨水的浆料中通入二氧化碳可生成碳酸盐或碳酸氢盐,过滤后滤液为硫酸铵、氨水,滤渣含有碳酸钙、SiO2、Al2O3等,高温煅烧生成硅酸钙、偏铝酸钙等,加入氯化铵溶液充分浸取,可生成硅酸、氢氧化铝、氯化钙等,氯化钙最终可生成碳酸钙.
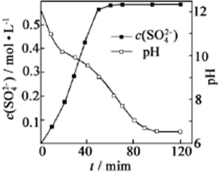
(1)由图象可知,经充分浸取,c(SO42-)逐渐增大,pH逐渐减小,清液pH>11时CaSO4生成碳酸钙、铵根离子和硫酸根离子;
(2)当清液pH接近6.5时,溶液酸性相对较强,可充分转化生成SO42-并有HCO3-生成,沉淀吸附SO42-,可用盐酸酸化的氯化钡检验;
(3)磷石膏(主要成分CaSO4,杂质SiO2、A12O3等)用氢氧化钠溶液溶解,其成分中氧化铝和氢氧化钠反应生成偏铝酸钠和水,二氧化硅和氢氧化钠反应生成硅酸钠和水.
解答 解:磷石膏氨水的浆料中通入二氧化碳可生成碳酸盐或碳酸氢盐,过滤后滤液为硫酸铵、氨水,滤渣含有碳酸钙、SiO2、Al2O3等,高温煅烧生成硅酸钙、偏铝酸钙等,加入氯化铵溶液充分浸取,可生成硅酸、氢氧化铝、氯化钙等,氯化钙最终可生成碳酸钙.
(1)由图象可知,经充分浸取,c(SO42-)逐渐增大,pH逐渐减小,清液pH>11时CaSO4生成碳酸钙、铵根离子和硫酸根离子,反应的离子方程式为CaSO4+2NH3•H2O+CO2=CaCO3+2NH4++SO42-+H2O或CaSO4+CO32-=CaCO3+SO42-,
故答案为:CaSO4+2NH3•H2O+CO2=CaCO3+2NH4++SO42-+H2O或CaSO4+CO32-=CaCO3+SO42-;
(2)当清液pH接近6.5时,溶液酸性相对较强,可充分转化生成SO42-并有HCO3-生成,沉淀吸附SO42-,可用盐酸酸化的氯化钡检验,方法是取少量最后一次的洗涤过滤液与试管中,向其中滴加盐酸酸化的氯化钡溶液,若不产生白色沉淀,则表明已洗涤完全,
故答案为:HCO3-;取少量最后一次的洗涤过滤液与试管中,向其中滴加盐酸酸化的氯化钡溶液,若不产生白色沉淀,则表明已洗涤完全;
(3)磷石膏(主要成分CaSO4,杂质SiO2、A12O3等)用氢氧化钠溶液溶解,氧化铝为两性氧化物,能和氢氧化钠反应生成偏铝酸钠和水,离子反应为:Al2O3+2OH-+3H2O═2[Al(OH)4]-,二氧化硅为酸性氧化物和氢氧化钠反应生成硅酸钠和水,离子反应为:SiO2+2OH-═SiO32-+H2O,
故答案为:Al2O3+2OH-+3H2O═2[Al(OH)4]-;SiO2+2OH-═SiO32-+H2O.
点评 本题以实验流程的形成综合考查元素化合物知识,侧重于学生的分析能力和实验能力的考查,题目难度中等,注意把握提给信息以及相关物质的性质.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向淀粉碘化钾溶液中滴加少量氯水,溶液变蓝,说明氯水中含有ClO- | |
| D. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分馏石油时的温度计 | B. | 制备氢气的简易装置中的长颈漏斗 | ||
| C. | 制备氯气装置中的分液漏斗 | D. | 制备乙酸乙酯时冷凝蒸气的导管 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com