
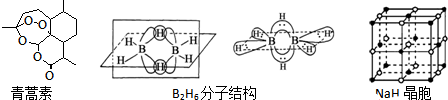
 ;
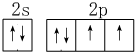
;分析 (1)组成青蒿素的三种元素为H、C、O,非金属性越强电负性越大;基态O原子最外层有6个电子,即价电子数为6,据此画出电子排布图;
(2)碳原子周围连有四个不同的原子或原子团即为手性碳,结合青蒿素的结构简式判断;
(3)①原子总数相同、价电子总数相同的微粒互为等电子体;
②根据B2H6分子的结构可知,B2H6分子中有B-H共价键,另外还3中心二电子键,每个B原子周围有4个共价键,据此判断杂化方式;
③B原子核外层只有两个电子层,L层上没有d轨道,而Al原子核外层只有三个电子层,M层上有d轨道,据此答题;
④根据NaH的晶胞结构图可知,NaH晶体中每个钠离子周围有6个氢负离子,设晶胞中阴、阳离子为刚性球体且恰好相切,如图所示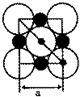 ,则NaH晶体中阴阳离子的最短距离为a的一半即 $\frac{a}{2}$,阳离子的半径为对角线的 $\frac{1}{4}$,即为 $\frac{\sqrt{2}}{4}$a,所以阴离子的半径为即 $\frac{a}{2}$-$\frac{\sqrt{2}}{4}$a,据此计算阴、阳离子的半径比.
,则NaH晶体中阴阳离子的最短距离为a的一半即 $\frac{a}{2}$,阳离子的半径为对角线的 $\frac{1}{4}$,即为 $\frac{\sqrt{2}}{4}$a,所以阴离子的半径为即 $\frac{a}{2}$-$\frac{\sqrt{2}}{4}$a,据此计算阴、阳离子的半径比.
解答 解:(1)组成青蒿素的三种元素为H、C、O,元素的非金属性越强,电负性越强,非金属性:O>C>H,则H、C、O三种元素的电负性由大到小的顺序是O>C>H,基态O原子最外层有6个电子,即价电子数为6,所以氧原子的价电子的排布图为 ,
,
故答案为:O>C>H; ;
;
(2)碳原子周围连有四个不同的原子或原子团即为手性碳,根据青蒿素的结构简式可知,青蒿素分子中含有7个手性碳原子,
故答案为:7;
(3)①原子总数相同、价电子总数相同的微粒互为等电子体,所以与BH4-的等电子体的分子为CH4,离子为NH4+,
故答案为:CH4、NH4+;
②根据B2H6分子的结构可知,B2H6分子中有B-H共价键,另外还3中心二电子键,所以B2H6分子中有2种共价键,每个B原子周围有4个共价键,所以B原子的杂化方式为sp3,
故答案为:2;sp3;
③B原子核外层只有两个电子层,所以B原子价电子层上没有d轨道,而Al原子核外层只有三个电子层,Al原子价电子层上有d轨道,所以NaBH4的阴离子中一个B原子能形成4个共价键,而冰晶石(Na3AlF6)的阴离子中一个Al原子可以形成6个共价键,
故答案为:B原子价电子层上没有d轨道,Al原子价电子层上有d轨道;
④根据NaH的晶胞结构图可知,NaH晶体中每个钠离子周围有6个氢负离子,所以NaH晶体中阳离子的配位数是6,设晶胞中阴、阳离子为刚性球体且恰好相切,如图所示 ,则NaH晶体中阴阳离子的最短距离为a的一半即 $\frac{a}{2}$,阳离子的半径为对角线的 $\frac{1}{4}$,即为 $\frac{\sqrt{2}}{4}$a,所以阴离子的半径为即 $\frac{a}{2}$-$\frac{\sqrt{2}}{4}$a,所以阴离子半径与阳离子半径之比为 $\frac{\frac{a}{2}-\frac{\sqrt{2}}{4}a}{\frac{\sqrt{2}a}{4}}$=$\sqrt{2}$-1=0.414,
,则NaH晶体中阴阳离子的最短距离为a的一半即 $\frac{a}{2}$,阳离子的半径为对角线的 $\frac{1}{4}$,即为 $\frac{\sqrt{2}}{4}$a,所以阴离子的半径为即 $\frac{a}{2}$-$\frac{\sqrt{2}}{4}$a,所以阴离子半径与阳离子半径之比为 $\frac{\frac{a}{2}-\frac{\sqrt{2}}{4}a}{\frac{\sqrt{2}a}{4}}$=$\sqrt{2}$-1=0.414,
故答案为:6;0.414.
点评 本题考查了晶胞的计算、核外电子排布、电负性、等电子体等知识点,晶胞结构对学生的空间想象有一定的要求,注意根据晶胞结构计算阴阳离子半径比的方法,难度中等..


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 向水中加入少量硫酸氢钠溶液,c(H+)增大,KW不变 | |
| B. | 降低温度,KW减小,pH不变 | |
| C. | 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 | |
| D. | 向水中加入少量NaClO固体,平衡向逆反应方向移动,c(H+)降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃保存在用橡皮塞的玻璃试剂瓶中 | |
| B. | 氢氟酸保存在用橡皮塞的玻璃试剂瓶中 | |
| C. | 固体烧碱放在广口塑料瓶中并且塑料盖盖严 | |
| D. | 液溴密封盛放在棕色瓶中,液面放一层水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L甲苯所含的分子数约为NA | |
| B. | 室温下,2.8g乙烯与丙烯的混合物中含碳原子的数目为0.2NA | |
| C. | 1 mol C30H62分子中含有共价键的数目为92NA | |
| D. | 1 mol氯气和足量甲烷在光照条件下反应可生成2NA个氯化氢分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数X>Y | B. | 离子半径X>Y | ||
| C. | X和Y一定在同一周期 | D. | X是第IIA族元素,Y是第VIIA族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa2O2与2molNaHCO3固体混合物在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是NaOH和Na2CO3 | |
| B. | 由Na2O、Na2O2、Na2CO3•10H2O组成的混合物0.05 mol,溶于水后加入50 mL 2 mol/L的盐酸恰好完全反应,则原混合物中各成分的物质的量之比可以为任意值 | |
| C. | 向Na2 CO3饱和溶液中通入CO2,溶液变浑浊有晶体析出 | |
| D. | 将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL浓度为0.50 mol/L的HCl溶液中和,则该生成物的成分是Na2O和Na2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com