

| A. | 步骤①需要使用普通漏斗 | B. | 步骤②要使用分液漏斗 | ||
| C. | 步骤③要用到坩埚 | D. | 步骤④需要蒸馏装置 |
分析 步骤①是分离固液混合物,其操作为过滤,步骤②分离互不相溶的液体混合物,需进行分液,要用到分液漏斗;步骤③是从溶液中得到固体,操作为蒸发,需要蒸发皿;步骤④是从有机化合物中,利用沸点不同采取蒸馏得到甲苯,以此来解答.
解答 解:A.步骤①是分离固液混合物,其操作为过滤,需要过滤装置,步骤①需要使用普通漏斗,故A正确;
B.步骤②分离互不相溶的液体混合物,需进行分液,要用到分液漏斗,故B正确;
C.步骤③是从溶液中得到固体,操作为蒸发,需要蒸发皿,而不用坩埚,故C错误;
D.步骤④是从有机化合物中,利用沸点不同采取蒸馏得到甲苯,需要蒸馏装置,故D正确;
故选C.
点评 本题考查混合物的分离提纯,为高频考点,把握流程中物质的性质及分离方法是解答本题的关键,注重实验操作和分离方法的考查,题目难度不大.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 放电时正极附近溶液的碱性增强 | |
| B. | 放电时每转移3mol电子,正极有1mol K2FeO4被氧化 | |
| C. | 放电时正极反应为:Zn-2e-+2OH-═Zn(OH)2 | |
| D. | 该原电池,Zn作正极,可用石墨等作负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 无水三氯化铁易升华,有强烈的吸水性,是一种用途比较广泛的盐.
无水三氯化铁易升华,有强烈的吸水性,是一种用途比较广泛的盐.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷属于饱和链烃,乙烯属于不饱和链烃 | |
| B. | 乙烷分子则为立体结构,不是所有原子都在同一平面上,乙烯分子中所有原子都处于同一平面上 | |
| C. | 乙烷分子存在中的碳碳单键,乙烯分子存在中碳碳双键 | |
| D. | 酸性KMnO4溶液能鉴别乙烷和乙烯,而溴水不能鉴别乙烷和乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A | CO2(g) | SO2(g) | 饱和NaHSO3溶液,浓H2SO4 | 洗气 |
| B | 乙酸乙酯 | 乙酸 | 过量的饱和碳酸钠溶液 | 分液 |
| C | Na2CO3(s) | NaHCO3(s) | 无需添加 | 灼烧 |
| D | 甲烷 | 乙烯 | 酸性KMnO4,浓H2SO4 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
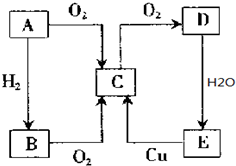 A、B、C、D、E五种物质有如图所示的转化关系,且物质A是一种淡黄色的固体单质,C气体能够使品红溶液褪色.
A、B、C、D、E五种物质有如图所示的转化关系,且物质A是一种淡黄色的固体单质,C气体能够使品红溶液褪色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤②③ | B. | ⑥②③① | C. | ⑤⑥③② | D. | ⑥②⑤① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=13的溶液:Na+、Ba2+、NH3、Cl- | |
| B. | 由水电离的c(H+)=1×10-14mol•L-1的溶液:K+、Ca2+、Cl-、HCO3- | |
| C. | Al(OH)3胶体:Na+、K+、Cl-、SO42- | |
| D. | 使甲基橙呈红色的溶液:Na+、Fe2+、SO42-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com