
| A. | 若甲为焦炭,则丁可能是O2 | B. | 若甲为SO2,则丁可能是氨水 | ||
| C. | 若甲为Fe,则丁可能是盐酸 | D. | 若甲为NaOH溶液,则丁可能是CO2 |
分析 A.甲为碳,丁为O2 物质转化关系为 C$\stackrel{O_{2}}{→}$CO$?_{C}^{O_{2}}$CO2;
B.若甲为SO2,则丁为氨水,物质转化关系为:SO2$\stackrel{氨水}{→}$NH4HSO3$?_{SO_{2}}^{氨水}$(NH4)2SO3;
C.若甲为Fe,丁为盐酸,铁和盐酸反应生成氯化亚铁和氢气,不能进一步和盐酸反应,若甲为Fe,丁是稀硝酸,则乙为硝酸亚铁、丙为硝酸铁;
D.若甲为NaOH溶液,丁是CO2,则乙为Na2CO3,丙为NaHCO3.
解答 解::A、甲为碳,丁为O2 物质转化关系为 C$\stackrel{O_{2}}{→}$CO$?_{C}^{O_{2}}$CO2,2C+O2=2CO,2CO+O2=2CO2,CO2+C$\frac{\underline{\;\;△\;\;}}{\;}$2CO,故A正确;
B、若甲为SO2,则丁为氨水,物质转化关系为:SO2$\stackrel{氨水}{→}$NH4HSO3$?_{SO_{2}}^{氨水}$(NH4)2SO3,(NH4)2SO3;SO2+NH3•H2O=NH4HSO3,NH4HSO3+NH3•H2O=(NH4)2SO3+H2O;(NH4)2SO3+H2O+SO2=2NH4HSO3,故B正确;
C.若甲为Fe,丁是稀硝酸,则乙为硝酸亚铁、丙为硝酸铁,硝酸铁与Fe反应得到硝酸亚铁,若甲为Fe,丁为盐酸,铁和盐酸反应生成氯化亚铁和氢气,不能进一步和盐酸反应,不符合转化关系,故C错误;
D.若甲为NaOH溶液,丁是CO2,则乙为Na2CO3,丙为NaHCO3,碳酸氢钠与氢氧化钠反应得到碳酸钠,符合转化关系,故D正确,
故选C.
点评 本题考查无机物的推断,综合考查元素化合物性质,关键是掌握物质之间的相互转化,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 只有强酸和强碱是强电解质,只有弱酸和弱碱是弱电解质 | |
| B. | 强电解质都是可溶性化合物,弱电解质都是难溶性化合物 | |
| C. | 易溶于水的强电解质水溶液中无溶质分子,易溶的弱电解质水溶液中有溶质分子 | |
| D. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
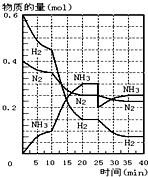 (1)在一定条件下,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图:
(1)在一定条件下,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0 | B. | 175 | C. | 57 | D. | 118 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com