
【题目】现用质量分数为98%、密度为1.84g/mL的浓硫酸来配制480mL0.2mol/L 的稀硫酸。可供选择的仪器有: ①玻璃棒②烧瓶③烧杯④胶头滴管⑤量筒⑥容量瓶⑦托盘天平⑧药匙。完成下列问题:
(1)上述仪器中,在配制稀硫酸时不需要用到的是______ (填仪器序号)。
(2)配制过程中需选用的容量瓶规格为_____mL,经过计算,需要量取的浓硫酸体积为_____mL。
(3)在配制过程中,下列操作使所配溶液浓度偏高的是______ (填字母)。
a.未洗涤稀释浓硫酸所用的烧杯和玻璃棒
b.为防止变质,稀释后的硫酸溶液立即就转移到容量瓶中
C.移液前,容量瓶中含有少量蒸馏水
d.定容时,俯视刻度线
【答案】 ②⑦⑧ 500 5.4 bd
【解析】(1)配制一定物质的量浓度硫酸溶液的一般步骤有:量取、稀释、冷却、移液、洗涤、定容、摇匀等操作,一般用量筒量取浓硫酸溶液在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器有玻璃棒、量筒、胶头滴管、小烧杯、500mL容量瓶,用不到的仪器有烧瓶、托盘天平、药匙,答案选②⑦⑧;(2)浓硫酸的物质的量浓度为![]() =18.4mol/L;配制480mL0.2mol/L的稀硫酸需要500mL容量瓶,设需要浓硫酸溶液的体积为V,0.2molL-1×500mL=V×18.4mol/L,解得:V=5.4mL;(3)a.未洗涤稀释浓硫酸所用的烧杯和玻璃棒,溶质减少,浓度偏低;b.为防止变质,稀释后的硫酸溶液立即就转移到容量瓶中,浓硫酸溶于水放热,冷却后溶液体积减少,浓度偏高;C.移液前,容量瓶中含有少量蒸馏水不影响;d.定容时,俯视刻度线,溶液体积减少,浓度偏高,答案选bd。
=18.4mol/L;配制480mL0.2mol/L的稀硫酸需要500mL容量瓶,设需要浓硫酸溶液的体积为V,0.2molL-1×500mL=V×18.4mol/L,解得:V=5.4mL;(3)a.未洗涤稀释浓硫酸所用的烧杯和玻璃棒,溶质减少,浓度偏低;b.为防止变质,稀释后的硫酸溶液立即就转移到容量瓶中,浓硫酸溶于水放热,冷却后溶液体积减少,浓度偏高;C.移液前,容量瓶中含有少量蒸馏水不影响;d.定容时,俯视刻度线,溶液体积减少,浓度偏高,答案选bd。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种抗酸药X(仅含五种短周期元素)的组成和性质,设计并完成了如下实验:
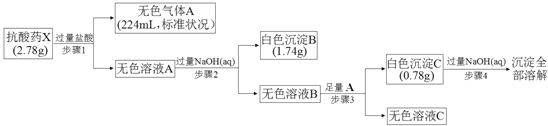
请回答下列问题:
(1)白色沉淀B中金属元素的离子结构示意图为_______,A的电子式为__________.
(2)步骤3中生成沉淀C的离子方程式为______________________________.
(3)X的化学式为______________,该抗酸药不适合胃溃疡重症患者使用,原因是______________________________.
(4)设计实验方案验证溶液C中的含碳酸氢根离子____________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁的工业生产流程如下:
![]()
下列说法错误的是
A.此法的优点之一是原料来源丰富
B.该提取镁的过程中涉及置换、分解、复分解和氧化还原反应
C.步骤①②③的目的是从海水中提取无水MgCl2
D.步骤②中加盐酸的离子方程式为Mg(OH)2+2H+=Mg2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝.电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用.
请回答:
(1)已知:2Al2O3(s)═4Al(g)+3O2(g)△H1=3351KJmol﹣1
2C(s)+O2(g)═2CO(g)△H2=﹣221KJmol﹣1
2Al(g)+N2(g)═2AlN(s)△H3=﹣318KJmol﹣1
碳热还原Al2O3合成AlN的总热化学方程式是___________________________。
(2)在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1:4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比).
反应ⅠCO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H4
CH4(g)+2H2O(g)△H4
反应ⅡCO2(g)+H2(g)![]() CO(g)+H2O(g)△H5
CO(g)+H2O(g)△H5
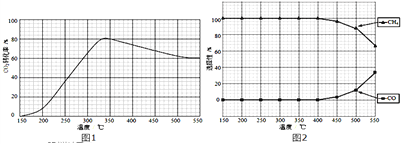
①下列说法不正确的是_______
A.△H4小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为VL该温度下反应Ⅰ的平衡常数为______(用a、V表示)
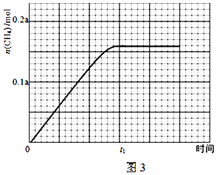
③350℃下CH4物质的量随时间的变化曲线如图3所示.画出400℃下0~t1时刻CH4物质的量随时间的变化曲线_______.
(3)据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是_______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中下列电离方程式书写不正确的是( )
A.H2SO4=2H+ + SO42-B.KHCO3=K++ HCO3-
C.NaOH=Na+ + OH-D.NaHSO4=Na++ HSO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中氯离子的物质的量浓度与50 mL1 mol·L-1AlCl3溶液中氯离子的物质的量浓度相等的是
A. 150 mL 3 mol·L-1氯酸钠溶液 B. 75 mL 3 mol·L-1氯化钙溶液
C. 150 mL 3 mol·L-1氯化钾溶液 D. 50 mL 3 mol·L-1氯化镁溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列叙述正确的是( )
A.pH等于5的HCl溶液和pH值等于9的NaOH溶液由水电离出的c(H+)之比为1:1
B.两种醋酸溶液的物质的量浓度分别为c1和c2 , pH分别为a和a+1,则c1=10c2
C.pH=2的HNO3溶液和pH=10的Ba(OH)2溶液等体积混合后的溶液的PH=7
D.向0.1mol/L的氨水中加入少量醋酸铵固体,则溶液中 ![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是生命之源,是一切生命活动的基础。下列有关水的说法不正确的是( )
A. 水可以参与细胞中的化学反应
B. 细胞内的许多化学反应需要有水参与
C. 种子入库前晒干的目的是减少种子体内的自由水和结合水
D. 自由水与结合水比值降低,会影响细胞的代谢活动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com