
分析 (1)煤燃烧产生的废气中含有二氧化硫,二氧化硫能引起酸雨;
(2)煤转化为中热值气,为煤的气化,生成CO、H2、CH4等,可作为化工生成的原料;
(3)根据工业把煤转化为焦炉气、煤焦油和焦炭等常用干馏的方法制备;从煤焦油中得到芳香族化合物常用分馏的方法制备;根据煤中含有碳元素,不含有氢元素,而燃油是多种烃的混合物,里面含有碳元素和氢元素;
(4)采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,可作为肥料,减低污染.
解答 解:(1)煤燃烧产生的废气中含有二氧化硫,二氧化硫能引起酸雨,故答案为:酸雨;
(2)煤转化为中热值气,为煤的气化,生成CO、H2、CH4等,可作为居民用煤气、合成氨、制甲醇的化工原料等,故答案为:CO、H2、CH4;居民用煤气;合成氨、制甲醇的原料;
(3)煤经过干馏可以得到炉煤气、煤焦油和焦炭;煤焦油经过分馏可得到芳香族化合物;因煤中含有碳元素,不含有氢元素,而燃油里面含有碳元素和氢元素,所以煤也可以用加氢转化成燃油,故答案为:干馏;分馏;增加煤中氢元素含量,提高氢碳比;
(4)采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,可作为肥料,减低污染,达到充分利用资源的目的,变废为肥,充分利用资源,降低污染,故答案为:既能吸收二氧化硫,又能生成复合肥磷铵.
点评 本题考查化学与环境、材料、信息、能源关系密切相关的知识,为高频考点,侧重于基础知识的综合理解和运用的考查,难度不大.


 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:解答题
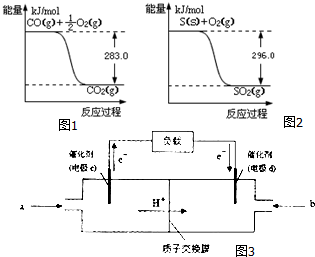 一氧化碳是一种用途广泛的化工基础原料.有机物加氢反应中镍是常用的催化剂.但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资
一氧化碳是一种用途广泛的化工基础原料.有机物加氢反应中镍是常用的催化剂.但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资查看答案和解析>>
科目:高中化学 来源: 题型:多选题
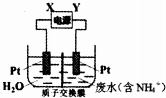
| A. | 直流电源中X为负极 | |
| B. | 阳极反应为2NH4+-6e-=N2↑+8H+ | |
| C. | 阴极反应为2H2O+2e-=H2↑+2OH- | |
| D. | 当有6mol电子转移时,质子交换膜两侧电解质溶液质量变化差为32 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
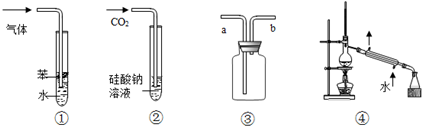
| A. | 装置①:可用于吸收NH3或HCl气体,并防止倒吸 | |
| B. | 装置②:持续通入CO2气体,先出现白色沉淀,后变澄清 | |
| C. | 装置③:若“a进b出”可用于收集NO2,若“b进a出”可用于收集NH3 | |
| D. | 装置④:可用于分离石油,得到汽油、煤油和柴油等各种纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中C的氢化物稳定性最强 | |
| B. | 同周期元素中A的金属性最强 | |
| C. | 原子半径:A>B,离子半径:A+>C- | |
| D. | A、B、C的简单离子中,会破坏水的电离平衡的是C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
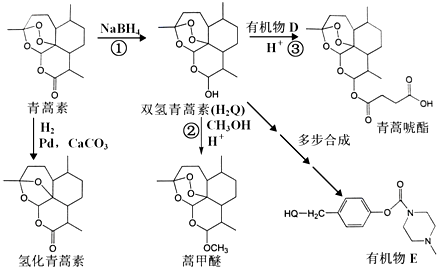
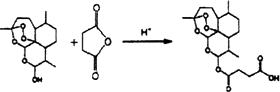 .
. 外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式
外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式 ,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.
,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
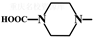
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
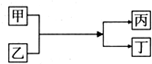
| A. | 若甲为铜,丁为氯化亚铁,则乙一定是氯化铁 | |
| B. | 若甲为水,丁为氢氧化钠,则丙一定是氢气 | |
| C. | 若甲为铝,丁为铁,则乙一定是氧化铁 | |
| D. | 若甲为镁,丁为氢气.则乙一定是酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com