
 某同学研究铝及其化合物的性质时设计了如下两个实验方案.
某同学研究铝及其化合物的性质时设计了如下两个实验方案.| 100mL稀盐酸 |
| NaOH溶液 |
| 100mLNaOH溶液 |
| 稀盐酸 |
| A、在O点时两方案中所得溶液的溶质物质的量相等 |
| B、b曲线表示的是向X溶液中加入NaOH溶液 |
| C、X溶液溶质为AlCl3,Y溶液溶质为NaAlO2 |
| D、a、b曲线表示的反应都是氧化还原反应 |
| 100mL稀盐酸 |
| NaOH溶液 |
| 100mLNaOH溶液 |
| 稀盐酸 |
| 2.7g |
| 27g/mol |


科目:高中化学 来源: 题型:

 .
.
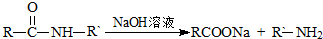
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
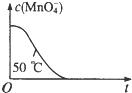
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol?L-1 | 体积/mL | 浓度/mol?L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
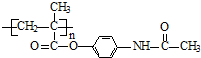
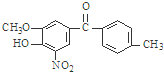 ,该有机物中含氧官能团有:
,该有机物中含氧官能团有: 的系统名称是
的系统名称是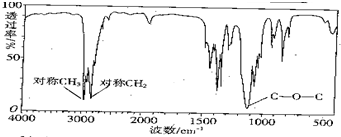
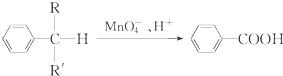 (R、R′表示烷基或氢原子)
(R、R′表示烷基或氢原子) 、
、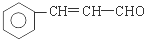 在强氧化剂条件下生成
在强氧化剂条件下生成 和另一种有机物
和另一种有机物查看答案和解析>>
科目:高中化学 来源: 题型:
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol?L-1 | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol?L-1 | 0.010 | 0.010 | 0.020 |
| A、平衡时,乙中CO2、H2的转化率相等 |
| B、平衡时,甲中和丙中H2转化率均是60% |
| C、平衡时,丙中c(CO2)是甲中的2倍,是0.008mol?L-1 |
| D、反应开始时,丙中的反应速率最快,甲中的反应速率最慢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com