
| A. | ②③ | B. | ①②③ | C. | ②③④ | D. | ①②④ |
分析 根据得电子的能力、最高价氧化物对应水化物的酸性、气态氢化物的稳定性等来判断非金属性的强弱.
解答 解:①共价键的极性:H-Cl>H-Br,说明Cl原子吸引电子能力大于Br原子,则非金属性Cl>Br,故正确;
②元素的非金属性越强,其最高价氧化物的水化物酸性越强,酸性:HClO4>HBrO4,则非金属性Cl>Br,故正确;
③元素的非金属性越强,其氢化物的稳定性越强,热稳定性:HCl>HBr,则非金属性Cl>Br,故正确;
④HCl的酸性比HBr强,说明HCl的电离程度大于HBr,不能说明非金属性Cl比Br强,故错误;
故选B.
点评 本题考查非金属性强弱判断,为高频考点,明确非金属性强弱判断方法是解本题关键,非金属性强弱与其氢化物的稳定性、最高价含氧酸酸性、反应难易程度、吸引电子能力等有关,与得电子多少无关,题目难度不大.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题

| A. | M的氧化物易溶于水 | |
| B. | 碳的最简单氢化物的稳定性强于A的 | |
| C. | 钾和B组成的化合物的水溶液显碱性 | |
| D. | A、B形成的化合物中可能含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2min时,c(SO2)=0.6mol•L-1 | |
| B. | 再向容器中充入1mol SO3,达到新平衡,n(SO2):n(SO3)=2:1 | |
| C. | 用O2表示4min内的反应速率为0.1mol•(L•min)-1 | |
| D. | 4min后,若升高温度,平衡向逆方向移动,平衡常数K增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=3 | |
| B. | 两次平衡的平衡常数相同 | |
| C. | X与Y的平衡转化率之比为1:1 | |
| D. | 第二次平衡时,Z的浓度为原平衡的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.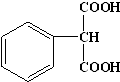 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com