
| A. | 硅原子和钠原子 | B. | 铜原子和氦原子 | C. | 碳原子和铝原子 | D. | 氧原子和碳原子 |
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:解答题
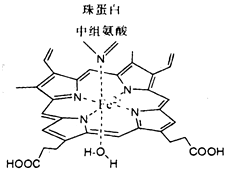 红细胞中血红素结构如图所示,回答下列问题:
红细胞中血红素结构如图所示,回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 检验FeCl3溶液中是否存在FeCl2 | 向溶液中滴加KSCN溶液后再滴加氯水 |
| B | 证明H2CO3酸性比H2SiO3强 | Na2CO3和SiO2在高温下熔融反应 |
| C | 除去Cu粉中混有的CuO | 向混合物中滴加适量稀硫酸并过滤 |
| D | 检验未知溶液一定含有CO32- | 加入稀盐酸有无色无味的气体生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH只与NH4HSO4反应 | |
| B. | (NH4)2SO4在水中的电离方程式:(NH4)2SO4=NH4++SO42- | |
| C. | NH4HSO4的物质的量是0.04 mol | |
| D. | (NH4)2SO4和NH4HSO4物质的量之比是1.87:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 燃烧法是测定有机化合物化学式的一种重要方法.现完全燃烧一定质量的某烃,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重3.6g,乙装置增重8.8g,又知该烃的蒸汽密度是同温同压下氢气密度的28倍.
燃烧法是测定有机化合物化学式的一种重要方法.现完全燃烧一定质量的某烃,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重3.6g,乙装置增重8.8g,又知该烃的蒸汽密度是同温同压下氢气密度的28倍.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、SO42-、Cl-、NO3- | B. | K+、Fe3+、Cl-、SCN- | ||
| C. | H+、Mg2+、SO42-、NO3- | D. | Al3+、K+、HS-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(N2)=0.2 mol•L-1•min-1 | B. | V(H2)=0.1 mol•L-1•min-1 | ||
| C. | V(NH3)=0.15 mol•L-1•min-1 | D. | V(H2)=0.4 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究表明,在CuZnO2催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
研究表明,在CuZnO2催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2(OH)2CO3 $\stackrel{H_{2}SO_{4}}{→}$ CuSO4(aq)$\stackrel{Na}{→}$Cu | |
| B. | 饱和食盐水$\stackrel{NH_{3}+CO_{2}}{→}$NaHCO3 $\stackrel{△}{→}$Na2CO3 | |
| C. | 海水$\stackrel{熟石灰}{→}$ Mg(OH)2 $\stackrel{△}{→}$ MgO $\stackrel{电解}{→}$ Mg | |
| D. | NH3 $→_{催化剂,△}^{O_{2}}$ N2 $\stackrel{O_{2}+H_{2}O}{→}$HNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com