
分析 (1)二氧化氮和水反应生成硝酸和NO气体;
(2)利用盖斯定律计算反应热,得到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,计算平衡时各物质的浓度,可计算平衡常数.
解答 解:(1)二氧化氮和水反应生成硝酸和NO气体,反应的化学方程式为3NO2+H2O═2HNO3+NO,故答案为:3NO2+H2O═2HNO3+NO;
(2)已知:①2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
②2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1,利用盖斯定律将①×$\frac{1}{2}$-②×$\frac{1}{2}$得NO2(g)+SO2(g)?SO3(g)+NO(g)
△H=$\frac{1}{2}$×(-196.6kJ•mol-1)-$\frac{1}{2}$×(-113.0kJ•mol-1)=-41.8kJ•mol-1,
a.无论是否达到平衡,体系压强都保持不变,不能用于判断是否达到平衡状态,故a错误;
b.混合气体颜色保持不变,说明浓度不变,达到平衡状态,故b正确;
c.SO3和NO的计量数之比为1:1,无论是否达到平衡,二者的体积比保持不变,不能判断是否达到平衡状态,故c错误;
d.物质的量之比等于化学计量数之比,则每消耗1mol SO3的同时生成1molNO2,不能判断是否达到平衡状态,故d错误.
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物质的体积 a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 a-x 2a-x x x
平衡时NO2与SO2体积比为1:6,即(1a-x):(2a-x)=1:6,故x=$\frac{4}{5}$a,故平衡常数K=$\frac{C(S{O}_{3})C(NO)}{c(N{O}_{2})C(S{O}_{2})}$=$\frac{x{\;}^{2}}{(a-x)(2a-x)}$=$\frac{\frac{16}{25}a{\;}^{2}}{\frac{1}{5}a×\frac{6}{5}a}$=$\frac{8}{3}$,
故答案为:-41.8;b;$\frac{8}{3}$.
点评 本题以NO2、SO2、CO等物质为载体,综合考查化学平衡移动、盖斯定律以及平衡常数的计算等问题,侧重于学生综合运用化学知识的能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 2gH2含有的氢原子数目为NA | |
| B. | 1L1mol•L-1KOH溶液中含有的钾离子数目为NA | |
| C. | 1molZn完全变为Zn2+失去的电子数目为NA | |
| D. | 常温常压下,22.4LO2含有的分子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积不变充入惰性气体,反应速率增大 | |
| B. | 其他条件不变,降低温度,平衡转化率一定变化 | |
| C. | 其他条件不变时,增大压强,平衡左移,平衡常数K减小 | |
| D. | 若增加或减少A物质的量,反应速率一定会发生明显的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ksp只与难溶电解质的性质和温度有关 | |
| B. | 由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 | |
| C. | 难溶电解质Mg(OH)2的Ksp=c( Mg2+)•c(OH-) | |
| D. | 25℃,Ksp(AgCl)=1.8×10-10,则AgCl饱和水溶液体系中c(Ag+)为$\sqrt{1.8}$×10-5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收 a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | FeS的Ksp小于CuS的Ksp | |
| B. | 达到平衡时c(Fe2+)=c(Cu2+) | |
| C. | 溶液中加入少量 Na2S固体后,溶液中c (Cu2+)、c (Fe2+)都减小 | |
| D. | 该反应平衡常数 K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(CuS)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
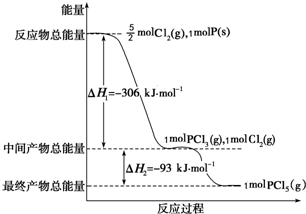 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该试剂的物质的量浓度为9.2 mol•L-1 | |
| B. | 该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L | |
| C. | 硫酸是强电解质 | |
| D. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com