
【题目】下列各组粒子在溶液中可以大量共存,且加入或通入试剂X后,发生反应的离子方程式也正确的是( )
选项 | 微粒组 | 加入试剂 | 发生反应的离子方程式 |
A | I-、Cl-、H+、SO42- | NaNO3 | 6I-+2NO3-+8H+=2NO↑+4H2O+3I2 |
B | CO32-、Fe3+、Br-、SO42- | KSCN | 3SCN-+Fe3+ |
C | HClO、Na+、K+、SO32- | CaCl2 | Ca2++ SO32-=CaSO3↓ |
D | K+、Na+、HCO3-、AlO2- | HCl | H++AlO2-+H2O=Al(OH)3↓ |
A.AB.BC.CD.D
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】已知:图甲是由某温度下![]() 、
、![]() 分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化图.图乙是常温下向100mL
分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化图.图乙是常温下向100mL![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,混合溶液的pH变化图.如图所示与推测的结论相符的是
溶液,混合溶液的pH变化图.如图所示与推测的结论相符的是
图甲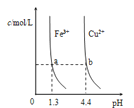 图乙
图乙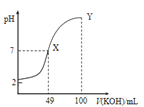
A.由图甲知:![]()
B.由图甲知:a、b点溶液中![]() ,b点的大
,b点的大
C.由图乙知:HA为强酸
D.由图乙知:Y点对应的溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )
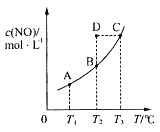
A.该反应的ΔH>0
B.若该反应在T1、T2℃时的平衡常数分别为K1、K2,则K1<K2
C.在T2℃时,若反应体系处于状态D,则此时v正>v逆
D.若状态B、C、D的压强分别为p(B)、p(C)、p(D),则p(C)=p(D)>p(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Fe3+的除杂,说法不正确的是( )
A.用加热的方法可除去KNO3溶液中混有的Fe3+
B.工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节pH至7~8,可除去Fe3+
C.FeSO4溶液中的Fe2+极易被氧化为Fe3+,可加铁粉除去杂质Fe3+
D.MgCl2溶液中混有FeCl3杂质,可加Na2CO3除去FeCl3杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A.Na2S显碱性原因:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
B.泡沫灭火器的原理:Al3++3HCO3-![]() Al(OH)3↓+3CO2↑
Al(OH)3↓+3CO2↑
C.HCO3的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
D.NH4Cl溶于D2O中:NH4++D2O![]() NH3·D2O+H+
NH3·D2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇属于可再生能源,可作汽车的燃料,下列能正确表示甲醇燃烧热的热化学方程式为
A.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=+763.3 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=+763.3 kJ·mol-1
B.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-763.3 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-763.3 kJ·mol-1
C.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-675.3 kJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH=-675.3 kJ·mol-1
D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1 526.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.用石灰石或石灰乳进行燃煤烟气脱硫![]() 除
除![]() 可获得副产品石膏
可获得副产品石膏
B.金属的电化学防护措施有牺牲阳极的阴极保护法和外加电流的阴极保护法
C.若在水果贮藏室中,放几块被![]() 溶液浸透过的“砖块”,可延长水果保存时间
溶液浸透过的“砖块”,可延长水果保存时间
D.常温时,某可逆反应的平衡常数越大则其反应速率就越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种重要的金属,以钛铁矿[主要成分为钛酸亚铁(FeTiO3),还含有少量Fe2O3]为原料制备钛的工艺流程如图所示。
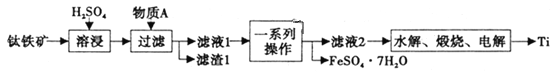
(1)滤液1中钛元素以TiO2+形式存在,则“溶浸”过程发生的主要反应的化学方程式为________。
(2)物质A为________(填化学式),“一系列操作”为________。
(3)“水解”步骤中生成TiO2·xH2O,为提高TiO2·xH2O的产率,可采取的措施有________、________。(写出两条)。
(4)“电解”是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。阴极的电极反应式为________;若制得金属Ti 9.60g,阳极产生气体________mL(标准状况下)。
(5)将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3,写出反应的离子方程式________;若反应后的溶液中c(Fe2+)=2×10-6mol·L-1,则溶液中c(CO32-)=________mol·L-1。(已知:常温下FeCO3饱和溶液浓度为4.5×10-6mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCN是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。
(1)含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。其中电解处理法如图:

用如图所示装置处理含CN-废水时,控制溶液pH为9~10并加入一定量的NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。铁电极为_____________(填“阴极”或“阳极”),阳极产生的ClO-的电极反应为_______________________,阳极产生的ClO-将CN-氧化为无害物质而除去的离子方程式为___________________________________。
(2)可用以下方法测定处理后的废水中NaCN的含量。已知:Ⅰ.废水中NaCN 的最高排放标准为0.50mg/L;Ⅱ.Ag+ +2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI沉淀呈黄色,且CN- 优先与Ag+反应。实验如下:20.00mL处理后的含NaCN 的废水于锥形瓶中,并滴加几滴KI 溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为15.00mL。
①滴定时1.00×10-4mol/L的标准AgNO3溶液应用_________________(填仪器名称)盛装;滴定终点时的现象是____________________________。
②处理后的含NaCN 的废水是否达到排放标准____________(填“是”或“否”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com