
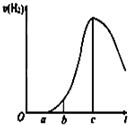
 某化学小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断.将5.4g铝片投入500mL 0.5mol•L-1的硫酸溶液中,下图为反应产氢速率与反应时间的关系图.
某化学小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断.将5.4g铝片投入500mL 0.5mol•L-1的硫酸溶液中,下图为反应产氢速率与反应时间的关系图.分析 (1)5.4gAl的物质的量为0.2mol,500mL 0.5mol•L-1的硫酸溶液中含硫酸的物质的量为0.25mol,Al过量,硫酸反应完全,由图可知,开始不生成氢气,为氧化铝与硫酸的反应,然后Al与硫酸反应生成氢气,开始温度较低,由于反应放热,则温度升高反应速率加快,之后氢离子浓度减小,则反应速率减小;
(2)O→a段无氢气产生,是铝片表面的氧化膜与盐酸反应生成盐和水;
(3)其他条件不变,现换用500mL 1mol•L-1盐酸,产生氢气速率普遍较使用500mL 0.5mol•L-1硫酸的快,氢离子浓度相同,只能是氯离子和硫酸根的作用;
(4)影响该化学反应速率的因素可能是温度、浓度、接触面积、原电池、催化剂等.
解答 解:(1)5.4gAl的物质的量为:0.2mol,500mL 0.5mol•L-1的硫酸溶液中含硫酸的物质的量为:0.5mol/L×0.5L=0.25mol,Al过量,硫酸反应完全,
①曲线a→b段产生H2加快可能是表面的氧化膜逐渐溶解,加快了反应速率,故①正确;
②曲线由a→c段,产生氢气的速率增加较快的主要原因为该反应为放热反应,温度升高,反应速率加快,故②正确;
③曲线由c以后,产生氢气的速率逐渐下降的主要原因为氢离子浓度减小,反应速率减小,故③错误;
故答案为:③;
(2)O→a段无氢气产生,是铝片表面的氧化膜与盐酸反应生成盐和水,反应离子方程式为:Al2O3+6H+=2Al3++3H2O,
故答案为:Al2O3+6H+=2Al3++3H2O;
(3)其他条件不变,现换用500mL 1mol•L-1盐酸,产生氢气速率普遍较使用500mL 0.5mol•L-1硫酸的快,氢离子浓度相同,只能是氯离子起了催化作用或SO42-有阻化作用(使反应变慢),
故答案为:②④;
(4)①加入某种催化剂,可以加快反应速率,故①正确;
②加入硫酸铜溶液,Al能够置换出铜,形成铝铜原电池,加快反应速率,故②正确;
③将铝片剪成100 条,增大了反应物的接触面积,反应速率加快,故③正确;
④硫酸的浓度至18mol/L时,Al在其中会钝化,故④错误;
⑤加入蒸馏水,降低氢离子浓度,反应速率减慢,故⑤错误;
⑥加入少量KNO3 溶液,溶液中氢离子与硝酸根离子和Al反应生成NO,不生成氢气,故⑥错误;
还可升高温度,加快铝片与硫酸溶液制H2的反应速率;
故答案为:升高温度;④⑤⑥.
点评 本题考查了化学反应速率的影响因素,为高频考点,题目难度中等,侧重于学生的分析能力的考查,注意根据图象分析理解随反应进行影响反应速率的主要因素,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题

 (不考虑空间构型,如有配位键,请标出)
(不考虑空间构型,如有配位键,请标出)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
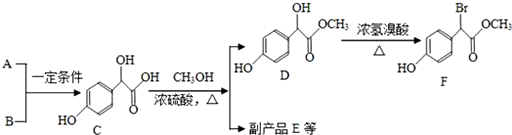
 .
.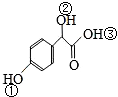 中①、②、③3个-OH的酸性有强到弱的顺序是:③>①>②.
中①、②、③3个-OH的酸性有强到弱的顺序是:③>①>②.
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
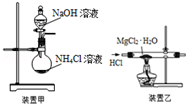
| A. | 焰色反应实验时,在蘸取待测液前,先用稀盐酸洗净铂丝并灼烧至无色 | |
| B. | 使用分液漏斗和容量瓶时,首先要查是否漏水 | |
| C. | 实验室用装置甲制取NH3 | |
| D. | 用装置乙制取无水MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
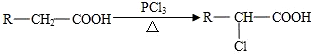
 .
. 与Br2,要想得到纯净的产物,可用NaOH溶液(或水)试剂洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.
与Br2,要想得到纯净的产物,可用NaOH溶液(或水)试剂洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人类利用能源的三个阶段分别是:柴草时期、化石能源时期、多能源结构时期 | |
| B. | 人类使用沼气是对化学能的充分利用 | |
| C. | 发展低碳经济、循环经济,开发推广太阳能、水能、风能等能源,减少煤、石油等化石燃料的使用 | |
| D. | 生物质能主要指用树木、庄稼、草类等植物直接或间接提供的能量,它是不可再生的能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com