
| A. | 该反应中氯气既是氧化剂又是还原剂 | |
| B. | KCl既是氧化产物又是还原产物 | |
| C. | 该反应中的氧化剂只有KOH | |
| D. | 氧化产物与还原产物物质的量之比为5:1 |
分析 6KOH+3Cl2=KClO3+5KCl+3H2O中,Cl元素的化合价由0升高为+5价,Cl元素的化合价由0降低为-1价,所以氯气既是氧化剂又是还原剂,化合价升高被氧化,化合价降低被还原,所以KCl是还原产物,KClO3是氧化产物,氧化产物与还原产物的物质的量之比是1:5,据此分析解答.
解答 解:A、化合价变化的元素只有氯元素,所以氯气既是氧化剂又是还原剂,故A正确;
B、Cl元素的化合价由0降低为-1价被还原,所以生成KCl是还原产物,故B错误;
C、化合价变化的元素只有氯元素,所以氯气既是氧化剂又是还原剂,故C错误;
D、KCl是还原产物,KClO3是氧化产物,氧化产物与还原产物的物质的量之比是1:5,故D错误.
故选A.
点评 本题考查氧化还原反应的特征和有关的概念内涵,要求学生具有分析和解决问题的能力,注意反应中只有一种元素化合价变化时的情况,难度较大.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:实验题
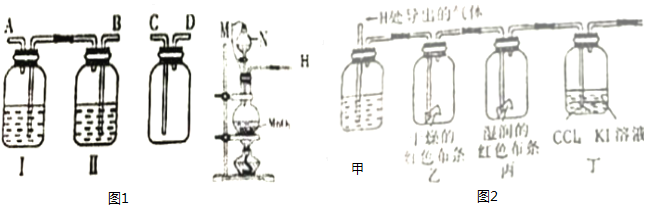
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄酒中添加SO2,可起到抗氧化和抗菌的作用 | |
| B. | PM2.5颗粒分散到空气中可产生丁达尔效应 | |
| C. | 苯、四氯化碳、乙醇都可作萃取剂,也都能燃烧 | |
| D. | 淀粉、油脂、纤维素和蛋白质都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
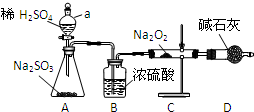

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
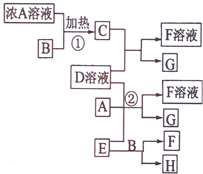 有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质,且受热易升华.实验室中,常用固体E在B的催化下加热制取气体单质H,H能使带火星的木条复燃.
有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质,且受热易升华.实验室中,常用固体E在B的催化下加热制取气体单质H,H能使带火星的木条复燃.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
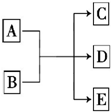 一定条件下,物质A~E转化关系如图所示,其中A为单质,常温下E为无色液体.
一定条件下,物质A~E转化关系如图所示,其中A为单质,常温下E为无色液体.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钡可以从氯化钾溶液中置换出钾 | |
| B. | 钡可以从冷水中置换出氢而得到氢气 | |
| C. | 钡可以从氯化钠溶液中置换出钠 | |
| D. | 钡不能置换出金属钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com