
| A. | PCl5的分解率大于a% | |
| B. | PCl5的分解率小于a% | |
| C. | 达到平衡后正逆反应速率比原平衡状态时大 | |
| D. | 达到平衡后正逆反应速率比原平衡状态时小 |
分析 反应PCl5(g)?PCl3(g)+Cl2(g)为正反应气体体积增大的可逆反应,1.0molPCl5充入体积不变的密闭容器中,可以假设放入另一相同容积的密闭容器中,相同条件下达到平衡时,与上一平衡状态完全相同,再压入一个容器中,平衡逆向移动,据此分析.
解答 解:反应PCl5(g)?PCl3(g)+Cl2(g)为正反应气体体积增大的可逆反应,1.0molPCl5充入体积不变的密闭容器中,可以假设放入另一相同容积的密闭容器中,相同条件下达到平衡时,与上一平衡状态完全相同,再压入一个容器中,相当于增大压强,平衡逆向移动,而各组分的浓度变大,所以PCl5的分解率小于a%,再次达到平衡后正逆反应速率比原平衡状态时大,
故选:BC.
点评 本题考查化学平衡的移动,题目难度中等,注意假设法的利用,相当于在原平衡的基础上增大压强,平衡逆向移动,但各给分的浓度都变大.


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子的比例模型: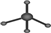 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 醛基的电子式: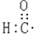 | D. | 甲醛的结构式: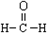 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②③ | B. | 只有①② | C. | 只有②③ | D. | 只有①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 操作方法 | 实验现象 | 结论或解释 |
| 1 | 观察氯水的颜色 | 含有Cl2 | |
| 2 | 有无色气体产生 | 含有H+ | |
| 3 | 取少量氯水于试管中,加入稀硝酸酸化的硝酸银溶液 | 有白色沉淀生成 | |
| 4 | 取少量氯水于试管中,放入红色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
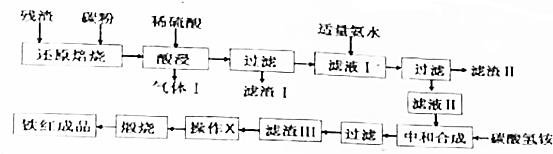
| 金属离子 | Fe3+ | Al3+ | Fe2+ |
| 开始沉淀的pH | 2.2 | 3.1 | 7.5 |
| 完全沉淀的pH | 3.5 | 5.4 | 9.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
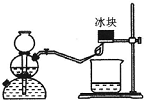 (1)下面所列的是中学化学实验室中几种常见的仪器:容量瓶、酸式滴定管、碱式滴定管、温度计、量筒、托盘天平、普通漏斗、玻璃棒、烧杯.
(1)下面所列的是中学化学实验室中几种常见的仪器:容量瓶、酸式滴定管、碱式滴定管、温度计、量筒、托盘天平、普通漏斗、玻璃棒、烧杯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
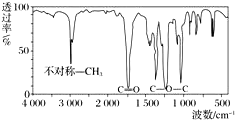 取8.8g有机物X,完全燃烧后只生成7.2g水和 8.96L CO2(标准状况),已知该有机物的蒸气对氢气的相对密度为44,其红外光谱图如图.关于X的说法错误的是( )
取8.8g有机物X,完全燃烧后只生成7.2g水和 8.96L CO2(标准状况),已知该有机物的蒸气对氢气的相对密度为44,其红外光谱图如图.关于X的说法错误的是( )| A. | 其化学式为C4H8O2 | |
| B. | 其满足右侧图象的酯有3种 | |
| C. | 鉴定该有机物的结构可用红外光谱或核磁共振氢谱 | |
| D. | 若结构为CH3COOCH2CH3,其核磁共振氢谱中有3个峰 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com