
如图是298 K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是 ( )。
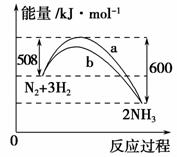
A.该反应的热化学方程式为N2+3H22NH3 ΔH=-92 kJ·mol-1
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热发生改变
D.温度、体积一定,1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1
解析 在热化学方程式中必须注明物质的状态,因此A错误;催化剂可以降低反应的活化能,加快化学反应速率,但反应热并不发生改变,B、C均错误;假设把1 mol N2和3 mol H2放在体积为V的密闭容器①中进行反应,2 mol N2和6 mol H2放在体积为2V的密闭容器②中进行反应,则两容器中N2和H2的转化率分别相等,反应放出的热量②是①的2倍;若把容器②加压使其体积变为V,则平衡向生成NH3的方向移动,N2的转化率增大,反应放出的热量增加,因此Q2>2Q1;由于N2与H2的反应为可逆反应,因此Q2小于2 mol N2和6 mol H2完全反应放出的热量184 kJ,因此D正确。
答案 D


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
 金晶体的最小重复单元(也称晶胞)是面心立方体,如图所示即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有。金原子的直径为d cm,用NA表示阿伏加德罗常数的值,M表示金的相对原子质量。
金晶体的最小重复单元(也称晶胞)是面心立方体,如图所示即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有。金原子的直径为d cm,用NA表示阿伏加德罗常数的值,M表示金的相对原子质量。
(1)金晶体每个晶胞中含有________个金原子。
(2)欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定________。
(3)一个金晶胞的体积是多少?
(4)金晶体的密度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨反应为:N2(g)+3H2(g)2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化。图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。

下列说法正确的是 ( )。
A.该反应为自发反应,由图1可得加入适当的催化剂,E和ΔH都减小
B.图2中0~10 min内该反应的平均速率v(H2)=0.045 mol·L-1·min-1,从11 min起其他条件不变,压缩容器的体积为1 L,则n(N2)的变化曲线为d
C.图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点
D.图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应类型中可以吸收能量的反应是 ( )。
①化合反应 ②分解反应 ③置换反应 ④复分解反应
⑤氧化还原反应
A.①②③④⑤ B.②④
C.①③④⑤ D.②
查看答案和解析>>
科目:高中化学 来源: 题型:
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为P4(s,白磷)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1
P(s,红磷)+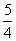 O2(g)===
O2(g)===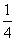 P4O10(s) ΔH2=-738.5 kJ·mol-1
P4O10(s) ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为_______________________
_______________________________________________________________。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)===P4O6(s)
ΔH=-1 638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为________,反应过程中放出的热量为________。
(3)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。则反应P4(s,白磷)+6Cl2(g)===4PCl3(s)的反应热
ΔH=________。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式中,正确的是 ( )。
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)2NH3(g) ΔH=-38.6 kJ·mol-1
C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ·mol-1
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ 热量,氢气燃烧的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
依据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题:

(1)电极X的材料是________;电解质溶液Y是___________________ _________________________________________________。
(2)银电极为电池的________极,发生的电极反应为__________________。
(3)外电路中的电子流向为__________________________________________。
(4)盐桥中的Cl-向________极移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,反应:2NO(g)+O2(g)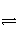
 2NO2(g)在定容容器中发生,对该反应达到平衡的标志的描述中,错误的是( )
2NO2(g)在定容容器中发生,对该反应达到平衡的标志的描述中,错误的是( )
A.混合气体的总分子数不再变化
B.混合气体的颜色不再变化
C.容器的总压强不再变化
D.混合气体的总质量不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com