
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物。下表各组物质之间通过一步反应不能实现如图所示转化的是( )
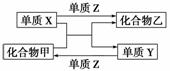
| 选项 | X | Y | Z | 甲 | 乙 |
| A | H2 | Si | Cl2 | SiCl4 | HCl |
| B | Mg | C | O2 | CO2 | MgO |
| C | Zn | Fe | Cl2 | FeCl2 | ZnCl2 |
| D | Cl2 | N2 | H2 | NH3 | HCl |
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
已知298 K时,合成氨反应N2(g)+3H2(g)===2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)( )
A.一定小于92.0 Kj B.一定大于92.0 kJ
C.一定等于92.0 kJ D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B=H++HB-,HB-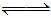 H++B2-。
H++B2-。
回答下列问题:
(1)Na2B溶液显 (填“酸性”、“中性”或“碱性”),理由是
(用离子方程式表示)。
(2)在0.1 mol·L-1 Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1 B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-) D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,则0.1 mol·L-1H2B溶液中氢离子的物质的量浓度可能是 0.11 mol·L-1(填“<”、“>”或“=”),理由是
。
(4)0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见下图)。下列说法正确的是(双选)( )
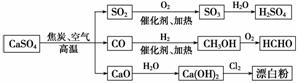
A.CO、SO2、SO3均是酸性氧化物
B.除去与水反应,图示转化反应均为氧化还原反应
C.工业上利用Cl2和石灰乳反应来制取漂白粉
D.用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100%
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程。
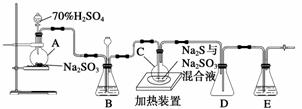
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq)(Ⅰ)2H2S(aq)+SO2(g)===3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)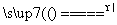 Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若__________________________________________________,则整个装置气密性良好。装置D的作用是________________________________________________________________________。
装置E中为______________溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为____________。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择________。
a.蒸馏水
b.饱和Na2SO3溶液
c.饱和NaHSO3溶液
d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是______________________________。已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是__________________________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有________。
a.烧杯 b.蒸发皿
c.试管 d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作、现象和结论:___________________________________________________
________________________________________________________________________。
已知Na2S2O3·5H2O遇酸易分解:S2O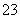 +2H+===S↓+SO2↑+H2O
+2H+===S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列转化关系中,X、Y是生活中用途广泛的两种金属单质,A、B是氧化物,A呈红棕色,C、D、E是中学常见的三种化合物。分析转化关系回答问题。
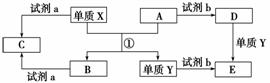
(1)请写出反应①的化学方程式:_________________________________________________。
(2)检验D溶液中Y离子的方法是______________________________________________。
(3)若试剂a是NaOH溶液,写出单质X与NaOH溶液反应的离子方程式__________________。
(4)若试剂b是H2SO4,工业上用E、H2SO4和NaNO2为原料制取高效净水剂Y(OH)SO4,已知还原产物为NO,则该反应的化学方程式是____________________________________。
(5)工业上电解熔融的B制取X时,若阳极产生的气体在标准状况下的体积为33.6 L,则阴极产物的质量为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.98 g H2SO4和H3PO4中含有的氧原子数均为4NA
B.1 L 1 mol·L-1的硫酸与高氯酸(HClO4)溶液中含有的氧原子数均为4NA
C.33.6 L NO2溶解于足量的水中得到硝酸溶液,溶液中NO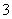 数目为NA
数目为NA
D.32 g铜发生氧化还原反应,一定失去NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.常温下pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度前者比后者大
B.用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3
C.BaSO4(s)+4C(s)===BaS(s)+4CO(g)室温下不能自发进行,说明该反应的ΔH﹤0
D. 为准确测定盐酸与氢氧化钠溶液反应的中和热,所用酸和碱的物质的量应相等
为准确测定盐酸与氢氧化钠溶液反应的中和热,所用酸和碱的物质的量应相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com