
| A. | Cu2++2OH-═Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+═CO2↑+H2O BaCO3+2HCl═BaCl2+CO2↑+H2O | |
| C. | Ca2++CO32-═CaCO3↓ Ca(NO3)2+NaCO3═CaCO3↓+NaNO3 | |
| D. | H++OH-═H2O 2KOH+H2SO4═K2SO4+2H2O |
分析 A、CuCO3是沉淀,不能拆;
B、BaCO3是沉淀,不能拆;
C、碳酸钠的化学式书写错误;
D、离子方程式H++OH-═H2O是强酸和强碱反应生成可溶性盐和水这一类酸碱中和反应的离子方程式.
解答 解:A、CuCO3是沉淀,不能拆,故Cu2+对应的化合物不能选CuCO3,只能选可溶性铜盐,故A错误;
B、BaCO3是沉淀,不能拆,故CO32-对应的化合物不能选BaCO3,只能选可溶性碳酸盐如碳酸钠,故B错误;
C、碳酸钠的化学式书写错误,应为Na2CO3,故C错误;
D、离子方程式H++OH-═H2O是强酸和强碱反应生成可溶性盐和水这一类酸碱中和反应的离子方程式,故可以改写成 2KOH+H2SO4═K2SO4+2H2O,故D正确.
故选D.
点评 本题考查了离子方程式的书写,明确反应的实质是解题关键,注意离子方程式书写应符合客观规律、应遵循原子个数、电荷数守恒.


科目:高中化学 来源: 题型:解答题
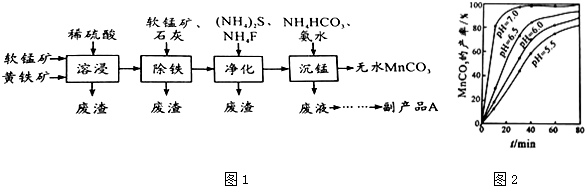
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组序 | 温度/℃ | 起始量/mol | 平衡量/mol | ||||
| CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||||
| 1 | 500 | 2 | 4 | 0 | 1 | ||
| 2 | 500 | 1.4 | 2.8 | 0.6 | a | ||
| 3 | 750 | 0 | 0 | 2 | 0.8 | ||
| 4 | 750 | 0.8 | 1.6 | 1.2 | b | ||
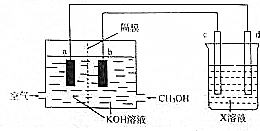
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Na+、Fe3+、NO3-、OH- | |
| B. | 滴加酚酞溶液呈红色:K+、NO3-、H+、HCO3- | |
| C. | 0.1 mol•L-1 CaCl2的溶液中:Na+、K+、CO32-、SO42- | |
| D. | 能与Mg反应生成H2的溶液:Na+、K+、SO42-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯使溴的四氯化碳溶液褪色 | |
| C. | 甲烷与氯气混合光照一段时间后黄绿色褪色 | |
| D. | 乙烯在催化剂作用下生成聚乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ②⑤ | D. | ⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-、HCO3-、Na+ | B. | Cu2+、NH4+、OH- | C. | Ba2+、K+、NO3- | D. | Ag+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com