
| 汁液 | 新鲜的黄瓜汁液 | 放置一周的黄瓜汁液 |
| 滴数 | 12 | 20 |
分析 (1)根据对照实验:使相同量的蓝色碘的淀粉溶液褪色,需要新鲜的黄瓜汁液量少分析;
(2)通过实验可以看出,新鲜的黄瓜汁液中维生素C含量高;
(3)根据题干信息:黄瓜在食用时一般采取生吃或加食醋凉拌,说明维生素C在酸性条件下稳定,不宜采用高温煎炒说明维生素C在高温条件下易被氧化;
(4)根据维生素C具有还原性,易被氧化,能与碘反应,可加入显色颜色的氧化剂,碘与淀粉显蓝色,据此设计实验证明维生素C具有还原性.
解答 解:(1)根据实验可以看出,使2mL蓝色碘的淀粉溶液褪色,需要新鲜的黄瓜汁液量12滴,需要放置一周的黄瓜汁液20滴,所以新鲜的黄瓜汁液中维生素花C的含量高,
故答案为:新鲜的黄瓜;
(2)由此可知维生素C的含量随着放置时间的增长会减少,新鲜的黄瓜汁液中维生素C含量高,要吃新鲜蔬菜和水果,
故答案为:要吃新鲜蔬菜和水果;
(3)黄瓜在食用时一般采取生吃或加食醋凉拌,说明维生素C在酸性条件下稳定,不宜采用高温煎炒说明维生素C在高温条件下易被氧化,据此推测维生素C除了具有还原性外可能还具有的性质的是:维生素C在酸性条件下稳定,维生素C在高温条件下易被氧化,
故答案为:维生素C在酸性条件下稳定;维生素C在高温条件下易被氧化;
(4)根据上述实验的信息可知:维生素C片(果汁等)富含维生素,维生素C具有还原性,易被氧化,能与碘反应,碘与淀粉显蓝色,所以可设计实验证明维生素C具有还原性方案为:试剂:维生素C片(果汁等)、碘水、淀粉;现象:蓝色的碘水-淀粉溶液褪色;结论:维生素C具有还原性,
故答案为:试剂为维生素C片(果汁等)、碘水、淀粉,现象为蓝色的碘水-淀粉溶液褪色,结论为维生素C具有还原性.
点评 本题为维生素C为载体考查化学实验方案的设计与评价,题目难度不大,注意根据题干提供的信息结合物质的性质设计实验方案,把握常见具有氧化性的物质及其颜色.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ④①③② | C. | ②①③④ | D. | ①③②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
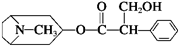
| A. | ①和④ | B. | ②和③ | C. | ①和③ | D. | ②和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | A | B | C | D | E | F |
性质或结构 信息 | 形成化合物种类最多的元素 | 最高正价是最低负价绝对值的3倍 | 族序数等于周期数的3倍 | 周期数是族序数的3倍 | 地壳中含量最高的金属元素 | 最高价氧化物对应水化物是最强的含氧酸 |
 元素F的最高价氧化物的化学式为Cl2O7.
元素F的最高价氧化物的化学式为Cl2O7.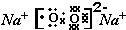 ,甲与乙反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2.
,甲与乙反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2.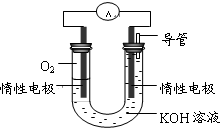
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
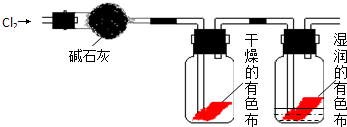
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的金属性大于X | B. | Y2的还原性大于X2 | ||
| C. | Y的非金属性大于X | D. | Y2的氧化性大于X2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com