
| A. | 决定反应速率的主要因素有浓度、压强、温度 | |
| B. | 容量瓶、量筒个滴定管上都标有使用温度,容量瓶无“0”刻度,量筒、滴定管有“0”刻度;实验时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| C. | 为实验安全,金属钠切割下来的表层物质反应放回原试剂瓶,不能再研磨氯酸钾或硝酸钾 | |
| D. | 皂化反应结束后的混合液中加入饱和食盐水,再通过分液操作分离出硬质酸钠 |
分析 A.影响反应速率的主要因素为物质的本身性质;
B.量筒无“0”刻度;
C.试验后应将剩余的金属钠放回原试剂瓶;
D.通过过滤操作分离出硬脂酸钠.
解答 解:A.影响反应速率的主要因素为物质的本身性质,浓度、压强、温度为外界因素,故A错误;
B.量筒无“0”刻度,故B错误;
C.金属钠易燃,试验后应将剩余的金属钠放回原试剂瓶,研磨氯酸钾或硝酸钾易发生爆炸,故C正确;
D.加入饱和食盐水发生盐析,通过过滤操作分离出硬脂酸钠,故D错误.
故选C.
点评 本题考查较为综合,涉及基础实验操作,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的方法、步骤和使用的仪器,注重相关基础知识的积累,难度不大.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10℃时0.1 mol/L Na2S2O3和0.1 mol/L H2SO4各 5 mL | |
| B. | 20℃时0.1 mol/L Na2S2O3和0.1 mol/L H2SO4各 5 mL | |
| C. | 10℃时0.1 mol/L Na2S2O3和0.1 mol/L H2SO4各5 mL,加水10mL | |
| D. | 20℃时0.2mol/L Na2S2O3和0.1 mol/LH2SO4各5 mL,加水10 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对甲苯酚和苯甲醇 | B. | 甲酸甲酯和甲醛 | ||
| C. | 苯和乙烯 | D. | CH3CH2OH和CH3CH2CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 | B. | 15 | C. | 20 | D. | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 盐酸 | 水煤气 | 硫酸 | 干冰 |
| B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
| C | 胆矾 | 氢氧化铁胶体 | 铁 | 碳酸钙 |
| D | 水银 | 澄清石灰水 | 氯化铜 | 碳酸钠 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 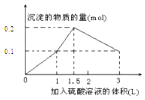 | B. | 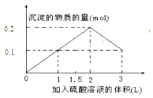 | ||
| C. | 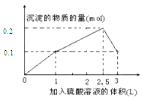 | D. | 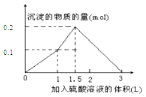 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 用标签所示浓盐酸配制250mL 0.4mol/L的稀盐酸,并进行有关实验.请回答:
用标签所示浓盐酸配制250mL 0.4mol/L的稀盐酸,并进行有关实验.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com