
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:选择题
| A. | 6.72 L CO | B. | 6.6 g CO2 | C. | 24 g SO3 | D. | 9.8 g H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含质子数为(A-n) | B. | 所含中子数为Z | ||
| C. | 所含电子数为(Z+n) | D. | 中子数-电子数=A-2Z+n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙在水中溶解度很小,其溶液的电阻率很大,所以碳酸钙是弱电解质 | |
| B. | 碳酸钙在水中的溶解度很小,但被溶解的碳酸钙全部电离,所以碳酸钙是强电解质 | |
| C. | 氯气和氨气的水溶液导电性都很好,所以它们是强电解质 | |
| D. | 水难电离,纯水几乎不导电,所以水是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4OH--4e-═O2↑+2H2O | B. | Zn--2e-?Zn 2+ | ||
| C. | O2+2H2O+4e-═4OH- | D. | 2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质名称 | 红磷与白磷 | 庚烷与十六烷 | 氯仿与三氯甲烷 | 氕与氘、氚 | 新戊烷与2,2-二甲基丁烷 | 2-甲基戊烷与2,3-二甲基丁烷 |
| 相互关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
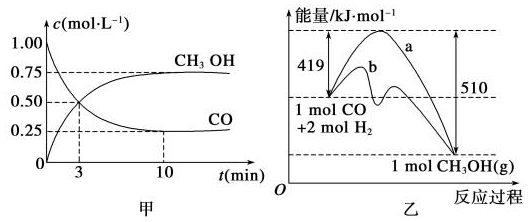
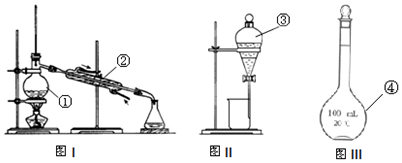
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
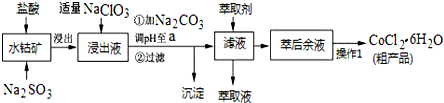
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
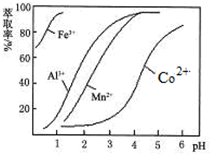
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com