
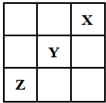
 短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )
短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )| A. | Y的氢化物稳定性大于Z的氢化物稳定性 | |
| B. | Z一定是活泼的金属元素 | |
| C. | Y的最高价氧化物的水化物是一种强酸 | |
| D. | 1molX的单质可以跟足量水反应,转移的电子为2mol |
分析 短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,结合位置可知,X一定为第一周期元素,最外层电子数为2,应为He元素,结合三种元素在周期表中的相对位置可知Y为F元素,Z为S元素,结合元素周期律知识判断元素对应单质、化合物的性质.
解答 解:由元素在周期表中的位置可知X为He元素,Y为F元素,Z为S元素,则
A.非金属性:F>S,则稳定性:HF>H2S,故A正确;
B.Z为S元素,为非金属元素,故B错误;
C.Y为F元素,无正价,不存在最高价氧化物的水化物,故C错误;
D.X为He元素,性质稳定,不与水反应,故D错误.
故选A.
点评 本题考查位置结构性质的相互关系及应用,为高频考点,把握元素的位置和性质、元素周期律为解答的关键,注意短周期及X为He为突破口,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
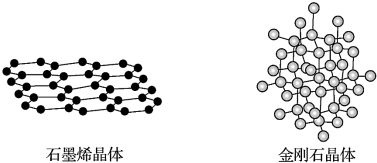
| A. | 在石墨烯晶体中,每个C原子连接3个六元环 | |
| B. | 在石墨烯晶体中,每个六元环占有3个C原子 | |
| C. | 在金刚石晶体中,C原子所连接的最小环为六元环,每个7C原子连接12个六元环 | |
| D. | 在金刚石晶体中,六元环中最多有4个C原子在同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; 的系统名称为:3,4,4一三甲基一l一戊炔
的系统名称为:3,4,4一三甲基一l一戊炔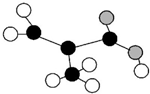 所示(图中球与球之间的连线代表化学键,如单键、双键等).该分子的结构简式为
所示(图中球与球之间的连线代表化学键,如单键、双键等).该分子的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的还原性:K>Na>Mg>Al | |
| B. | 氢化物的稳定性:HCl<H2S<PH3<SiH4 | |
| C. | 酸性:H2CO3<H3PO4<H2SO4<HClO4 | |
| D. | 原子的氧化性:F>Cl>S>P |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组为探究元素性质的递变规律,设计可如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计可如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl、HCl、S | B. | 金刚石、Na3PO4、MgO | ||
| C. | HF、SiC、Ar | D. | H2O、SiO2、K2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com