
分析 (1)根据电池总反应Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O可知负极铅失电子发生氧化反应,电极反应为Pb-2e-+SO42-=PbSO4 ,正极二氧化铅得电子发生还原反应,电极反应为PbO2+2e-+4H++2SO42-=PbSO4+2H2O;
(2)负极板增加的质量等于负极参加反应的硫酸根的质量,根据电池总反应计算消耗硫酸的物质的量.
解答 解:(1)二氧化铅作正极得电子发生还原反应,电极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O,
故答案为:PbO2+2e-+4H++SO42-=PbSO4+2H2O;
(2)铅作负极,电极反应式为Pb-2e-+SO42-=PbSO4,当外电路通过1mol电子时,负极生成0.5mol PbSO4,则负极板的质量增加0.5mol×96g/mol=48g;
根据电池总反应Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O可知有2mol硫酸参加反应时,转移电子的物质的量是2mol,所以当外电路通过1mol电子时,消耗硫酸的物质的量是1mol,
故答案为:48;1mol.
点评 本题考查了原电池原理,会根据电池反应式及元素化合价变化书写正负极电极反应式,再结合各个物理量之间的关系式进行计算,注意:负极上生成难溶性的硫酸铅导致负极质量增加,题目难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 项目 | 空气污染指数(API) | 空气质量级别 | 空气质量描述 |
| 总悬浮颗粒 | 52 | Ⅱ | 良 |
| 二氧化硫 | 7 | I | 优 |
| 二氧化氮 | 24 | I | 优 |
| A. | 用煤和石油产品作燃料 | B. | 汽车排放的尾气 | ||
| C. | 使用含磷洗衣粉 | D. | 焚烧垃圾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积、对物质的量浓度的NaX和弱酸HX混合后的溶液中:C(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) | |
| B. | 等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32-)的大小关系为:②>④>③>① | |
| C. | 往0.1mol/L CH3COOH溶液中通入少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中$\frac{c(C{H}_{3}COOH)}{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}$增大 | |
| D. | Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
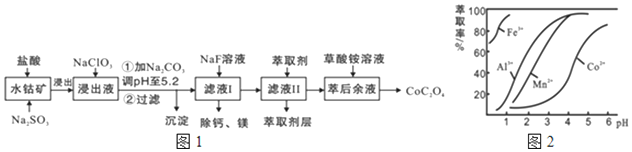
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的PH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2为V形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SF6中所有原子均满足8电子稳定结构 | |
| D. | SiF4和SO32-的中心原子均为印sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com