

 ;
;
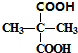 +2C2H5OH$→_{△}^{浓硫酸}$
+2C2H5OH$→_{△}^{浓硫酸}$ +2H2O.
+2H2O. 与足量NaOH溶液反应的化学方程式为
与足量NaOH溶液反应的化学方程式为 .
. 、
、 .
. 分析 丙烯与HBr发生加成反应生成A,A为溴代烷,A与KCN发生取代反应,生成 ,故A为
,故A为 ,由信息RCN$\stackrel{H_{2}O/H+}{→}$RCOOH,可知B为
,由信息RCN$\stackrel{H_{2}O/H+}{→}$RCOOH,可知B为 ,
,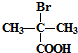 与KCN发生取代反应生成C,C为
与KCN发生取代反应生成C,C为 ,C$\stackrel{H_{2}O/H+}{→}$D,由信息RCN$\stackrel{H_{2}O/H+}{→}$RCOOH可知D为
,C$\stackrel{H_{2}O/H+}{→}$D,由信息RCN$\stackrel{H_{2}O/H+}{→}$RCOOH可知D为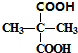 ,
,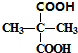 与足量的乙醇发生酯化反应生成E,E为
与足量的乙醇发生酯化反应生成E,E为 ,据此解答.
,据此解答.
解答 解:丙烯与HBr发生加成反应生成A,A为溴代烷,A与KCN发生取代反应,生成 ,故A为
,故A为 ,由信息RCN$\stackrel{H_{2}O/H+}{→}$RCOOH,可知B为
,由信息RCN$\stackrel{H_{2}O/H+}{→}$RCOOH,可知B为 ,
,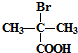 与KCN发生取代反应生成C,C为
与KCN发生取代反应生成C,C为 ,C$\stackrel{H_{2}O/H+}{→}$D,由信息RCN$\stackrel{H_{2}O/H+}{→}$RCOOH可知D为
,C$\stackrel{H_{2}O/H+}{→}$D,由信息RCN$\stackrel{H_{2}O/H+}{→}$RCOOH可知D为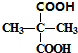 ,
,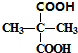 与足量的乙醇发生酯化反应生成E,E为
与足量的乙醇发生酯化反应生成E,E为 ,
,
(1)由上述分析可知,A的结构简式为  ,
,
故答案为: ;
;
(2)反应④是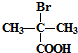 与KCN发生取代反应生成C,C为
与KCN发生取代反应生成C,C为 ,
,
故答案为:取代;
(3)由上述分析可知,C为 ,
,
故答案为: ;
;
(4)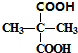 与足量的乙醇发生酯化反应生成
与足量的乙醇发生酯化反应生成 ,反应化学方程式为:
,反应化学方程式为: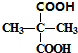 +2C2H5OH$→_{△}^{浓硫酸}$
+2C2H5OH$→_{△}^{浓硫酸}$ +2H2O,
+2H2O,
故答案为: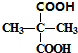 +2C2H5OH$→_{△}^{浓硫酸}$
+2C2H5OH$→_{△}^{浓硫酸}$ +2H2O;
+2H2O;
(5) 与足量NaOH乙醇溶液反应,发生卤代烃的水解溶液与羧酸的中和反应,反应方程式为:
与足量NaOH乙醇溶液反应,发生卤代烃的水解溶液与羧酸的中和反应,反应方程式为: ,
,
故答案为: ;
;
(6) 的同分异构体有多种,其中既能发生银镜反应,又能发生酯化反应,说明分子中含有醛基-CHO与羟基-OH,符合结构的有机物为:
的同分异构体有多种,其中既能发生银镜反应,又能发生酯化反应,说明分子中含有醛基-CHO与羟基-OH,符合结构的有机物为: 、
、 等
等
故答案为: 、
、 .
.
点评 本题考查有机推断与合成,涉及烯烃、卤代烃、醇、羧酸的性质以及根据信息进行的反应等,是对有机化合物知识的综合考查,利用给出的反应信息推断A的结构是解题的关键,然后利用顺推法推断其它物质,能较好的考查考生的阅读、自学能力和思维能力,是高考热点题型,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
 阅读、分析下列两个材料:
阅读、分析下列两个材料:| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 乙二醇C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇C3H8O3 | 17.9 | 290 | 1.26 | 跟水、酒精以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是碳元素的三种同位素 | |
| B. | 是不同的原子 | |
| C. | 化学性质完全不同 | |
| D. | 其中的 14C和14N所含的质量数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3常用于制造红色油漆和涂料 | |
| B. | 明矾能够消毒杀菌是利用了胶体的吸附性 | |
| C. | 氧化铝可用来制造耐高温的实验仪器 | |
| D. | 二氧化硅可用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 反应类型加聚反应(或聚合反应);
反应类型加聚反应(或聚合反应); 反应类型取代反应
反应类型取代反应 _反应类型加聚反应
_反应类型加聚反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.
某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.| Cl2的体积(标准状况) | 5.6L | 11.2L | 22.4L |
| n(Cl-) | 2.5mol | 3.0mol | 4.0mol |
| n(Br-) | 3.0mol | 2.8mol | 1.8mol |
| n(I-) | X mol | 0 | 0 |
| A. | X=0.3 | |
| B. | 溶液中n(Cl-):n(Br-):n(I-)=10:15:4 | |
| C. | 加入的氢氧化钠溶液的浓度为1.45mol•L-1 | |
| D. | 溶液中大量存在的离子共有六种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图是制取无水氯化铜的实验装置图,将分液漏斗中的浓硫酸滴加到盛有固体食盐和二氧化锰混合物的烧瓶中,请回答下列问题:
如图是制取无水氯化铜的实验装置图,将分液漏斗中的浓硫酸滴加到盛有固体食盐和二氧化锰混合物的烧瓶中,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com