金属钛被誉为“21世纪金属”,有“生物金属,海洋金属,太空金属”等美称.高纯钛具有比强度(即强度与密度之比)大、良好的可塑性、耐腐蚀、耐高温、耐低温、记忆能力等优良性能,但当有杂质存在时,钛就变得脆而硬,其他性能也大打折扣.
我国盛产钛铁矿.由钛铁矿制备高纯钛的工艺流程如下图:
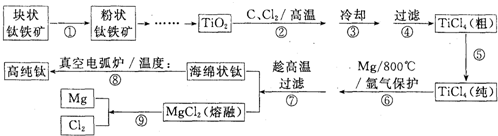
下表是上图中的部分物质的熔沸点:
| 物质 | Mg | Ti | MgCl2 | TiCl4 |
| 熔点/℃ | 648.8 | 1660 | 714 | -25 |
| 沸点/℃ | 1107 | 3287 | 1412 | 136.4 |
请填写下列空白:
(1)需进行第①步操作的作用是
.
(2)第②步中反应的化学方程式是:TiO
2+2C+2Cl
2TiCl
4+2CO.该反应的氧化剂是
,生成190kg TiCl
4时转移电子的物质的量是
mol.
(3)第④步中的过滤与第⑦步中的过滤在设备的要求上有什么不同?
.
(4)第⑤步提纯TiCl
4的方法是
,要得到纯净的TiCl
4,必须在
℃时收集.第⑧步的真空电弧炉中的温度接近
℃.
(5)已知钛的还原性介于铝与锌之间.估计钛能耐腐蚀的原因之一是
.如果可从Na、Zn、Fe三种金属中选一种金属代替第⑥步中的镁,那么,该金属跟四氯化钛反应的化学方程式是
.
(6)⑥⑦⑨三步操作需在稀有气体保护下进行的原因是
.




 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
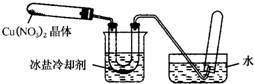 某化学探究小组拟用铜片制取Cu(NO3)2,并探究其化学性质.
某化学探究小组拟用铜片制取Cu(NO3)2,并探究其化学性质.