
| 元素 | 结构特点及元素、单质、化合物的性质 |
| X | 气态氢化物与最高价氧化物对应水化物可以化合成盐 |
| Y | 原子中s电子数与p电子数相同,且p电子的能量最高 |
| Z | 单质在空气中燃烧产生黄色火焰,生成黄色粉末 |
| W | 最外层电子排布(n+1)sn(n+1)pn-1 |
| T | 单质升华可以产生紫色的烟 |
 ;已知w 的氯化物在177.8°C时会发生升华现象,由此可以判断它的晶体类型为分子晶体.
;已知w 的氯化物在177.8°C时会发生升华现象,由此可以判断它的晶体类型为分子晶体.分析 五种主族元素中,X气态氢化物与最高价氧化物对应水化物可以化合成盐,则X为N元素;Y原子中s电子数与p电子数相同,且p电子的能量最高,核外电子排布为1s22s22p4,则Y为O元素;Z单质在空气中燃烧产生黄色火焰,生成黄色粉末,则Z为Na;W元素原子最外层电子排布(n+1)sn(n+1)pn-1,由于s能级只能容纳2个电子,且p能级已填充电子,故n=2,则W为Al;T单质升华可以产生紫色的烟,则T为I元素,据此解答.
解答 解:五种主族元素中,X气态氢化物与最高价氧化物对应水化物可以化合成盐,则X为N元素;Y原子中s电子数与p电子数相同,且p电子的能量最高,核外电子排布为1s22s22p4,则Y为O元素;Z单质在空气中燃烧产生黄色火焰,生成黄色粉末,则Z为Na;W元素原子最外层电子排布(n+1)sn(n+1)pn-1,由于s能级只能容纳2个电子,且p能级已填充电子,故n=2,则W为Al;T单质升华可以产生紫色的烟,则T为I元素.
(1)X为N元素,电子排布式为1s22s22p3;其单质中存在氮氮三键,化学性质稳定,该元素的非金属性强,证明其强弱的理由是:硝酸是强酸等,
故答案为:1s22s22p3;稳定;强;硝酸是强酸;
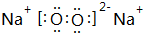
(2)Z单质在空气中燃烧生成黄色粉末为Na2O2,其电子式为 ;已知W的氯化物在177.8°C时会发生升华现象,熔沸点很低,由此可以判断它的晶体类型为:分子晶体,
;已知W的氯化物在177.8°C时会发生升华现象,熔沸点很低,由此可以判断它的晶体类型为:分子晶体,
故答案为: ;分子晶体;
;分子晶体;
(3)W的最高价氧化物对应的水化物为氢氧化铝,X、Z的最高价氧化物对应的水化物分别为硝酸、NaOH,氢氧化铝与硝酸、氢氧化钠反应的离子方程式:Al(OH)3+3H+=Al3++3H2O;Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;Al(OH)3+OH-=AlO2-+2H2O;
(4)O、I可形成多种化合物,其中I元素的化合价为+3、+5时,可以看作I2O3、I2O5 混合物,二者1:1混合时为I2O4,二者1:3混合时为I4O9,由O、I原子数目之比可知不可能为I6O10,由于I元素化合价可知,不能为I2O3,
故选:AB.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对元素周期律的理解掌握,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
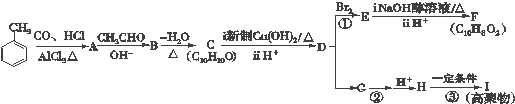
 $→_{AlCl_{3}△}^{CO、HCl}$
$→_{AlCl_{3}△}^{CO、HCl}$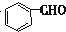
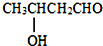 $→_{△}^{-H_{2}O}$CH3CH=CHCHO
$→_{△}^{-H_{2}O}$CH3CH=CHCHO .
.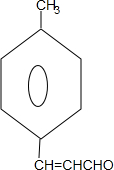 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$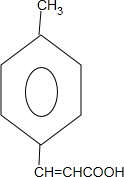 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.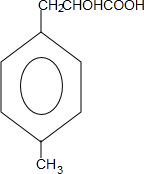 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$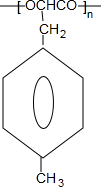 +nH2O.
+nH2O.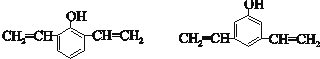 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2与足量Fe反应,转移的电子数为3NA | |
| B. | 1.5molNO2与足量H2O反应,转移的电子数为1.5NA | |
| C. | 常温常压下,46gNO2和N2O4混合气体含有的原子数为3NA | |
| D. | 含有H2SO41mol的浓硫酸与足量铜反应,生成SO2的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
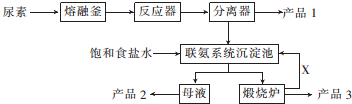
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
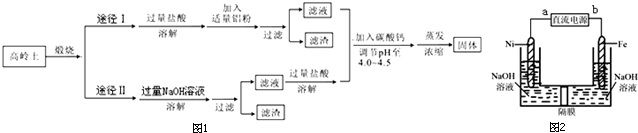
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO(NH2)2 | B. | (NH4)2CO3 | C. | NH4NO3 | D. | CH3COONH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com